南科大龚欣课题组揭示酵母鞘脂合成关键酶的协同调控机制
日期:2024-02-04
近日,南方科技大学生命科学学院副教授龚欣团队在Cell Reports杂志上在线发表了题为“Collaborative regulation of yeast SPT-Orm2 complex by phosphorylation and ceramide”的研究论文,该研究报道了酵母SPT-Orm2复合物通过磷酸化和神经酰胺协同调控维持细胞内鞘脂稳态的关键机制。
在真核生物中,SPT是催化鞘脂合成第一步也是限速步的关键酶。Orm家族蛋白是SPT的负调控因子,通过与SPT直接结合调控SPT的活性,从而控制细胞内鞘脂的稳态。酵母Orm具有不同于其它高等真核生物的磷酸化调控机制,当细胞中鞘脂含量较低时,Ypk1激酶能够将Orm蛋白的N端磷酸化,从而解除Orm对SPT的抑制作用,实现对细胞鞘脂稳态的调控。酵母中的SPT和Orm还能与磷酸肌醇磷酸酶Sac1形成稳定的复合物,称为“SPOTS”复合物。尽管课题组之前的研究表明,高等真核生物中SPT-ORM/ORMDL复合物存在保守的神经酰胺介导的负反馈调控机制,但该机制在酵母中是否保守存在,以及其与酵母中独特的磷酸化调控之间的关系尚不清楚。
在本研究中,研究人员通过体外重组表达、纯化的方法获得了酵母SPOTS复合物。为了研究Orm去磷酸化状态下SPOTS复合物调控鞘脂合成的分子机制,研究人员对去磷酸化状态的SPOTS复合物进行了冷冻电镜结构分析。通过对蛋白样品的优化,得到了除Sac1亚基之外的SPT-Orm2复合物的高分辨率冷冻电镜三维结构(图1)。通过对该结构的分析,发现神经酰胺分子结合其中,并将Orm2稳定于一种抑制SPT的构象。随后,研究人员通过利用模拟Orm2磷酸化状态的突变体,结合结构和生化实验,证明模拟Orm2磷酸化的突变体会破坏其抑制构象,从而解除对SPT活性的抑制。
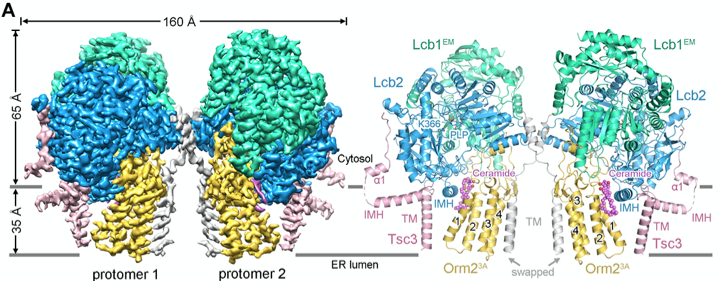
图1. 酵母SPT-Orm2复合物的三维结构
基于该研究中的结构分析、生化实验和酵母体内的研究结果,研究人员提出了酵母中磷酸化和神经酰胺协同调控SPT活性的工作模型(图2)。在该模型中,当细胞内鞘脂含量较低时,Orm2蛋白的N端被磷酸化,使得SPT-Orm2复合物保持在激活状态,细胞中鞘脂含量增加;当细胞鞘脂水平升高时,Orm2的去磷酸化以及神经酰胺的结合使得SPT-Orm2复合物进入抑制状态,进而使得细胞中鞘脂含量减少。SPT-Orm2复合物在激活状态和抑制状态的切换过程中,可能存在两个中间状态,分别为Orm2在磷酸化状态下结合神经酰胺和Orm2在去磷酸化状态下而没有神经酰胺的结合。因此,酵母SPT-Orm2复合物通过感知神经酰胺含量,并协同磷酸化调控,共同对细胞内鞘脂合成做出精确调控。该研究阐释了酵母中SPT-Orm2复合物独特于高等真核生物的调控机制。
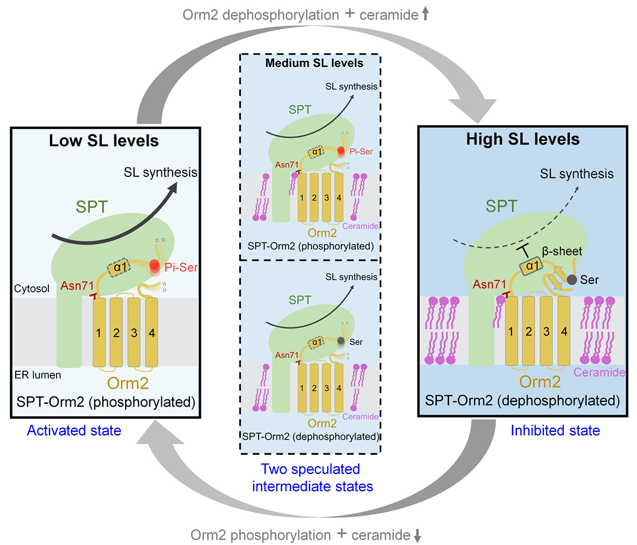
图2.酵母中磷酸化和神经酰胺协同调控SPT-Orm2复合物的工作模型
南科大生命科学学院研究副教授谢田、博士研究生董飞桐、硕士研究生吴欣悦,以及美国健康科学统一服务大学韩公社博士为本论文的共同第一作者,龚欣与美国健康科学统一服务大学教授Teresa M. Dunn为论文的共同通讯作者。南科大为论文第一单位。该工作得到了国家自然科学基金和深圳市科创委的资助。冷冻电镜数据收集和处理得到了南科大冷冻电镜中心的支持。
论文链接:https://doi.org/10.1016/j.celrep.2024.113717
供稿:生命科学学院
通讯员:付文卿
主图:丘妍
编辑:朱增光
最新动态
-
南科大赵燕团队合作揭示β-冠状病毒复制细胞器DMV聚集机制
Date:2024-04-22
-
爱丁堡大学生物科学学院Tilo Kunath教授一行 来访生命科学学院
Date:2024-04-19
-
我院研究生赴深圳高级中学开展生物特色科普实践活动
Date:2024-04-18
-
国际植物生长调节剂研讨会在我校召开
Date:2024-04-16
