南科大生物系黄鸿达课题组发表VASH2-SVBP进行微管去酪氨酸化分子机制研究成果
日期:2019-07-19
近日,南方科技大学生物系副教授黄鸿达课题组在Nature Structural & Molecular Biology杂志上发表了最新研究成果,从结构上阐明了VASH2-SVBP蛋白复合物进行微管蛋白去酪氨酸化的分子机制。
微管蛋白的“酪氨酸化-去酪氨酸化”循环在进化上非常保守,对于微管正常行使其多样性的功能起到关键的作用。研究发现,在稳定性高的微管中去酪氨酸化的微管蛋白含量较多,而在动态变化的微管中则相反。微管蛋白“酪氨酸化-去酪氨酸化”循环的失调将会导致微管功能的紊乱,甚至会导致例如心脏衰竭、大脑发育障碍、癌症等一系列疾病的发生。
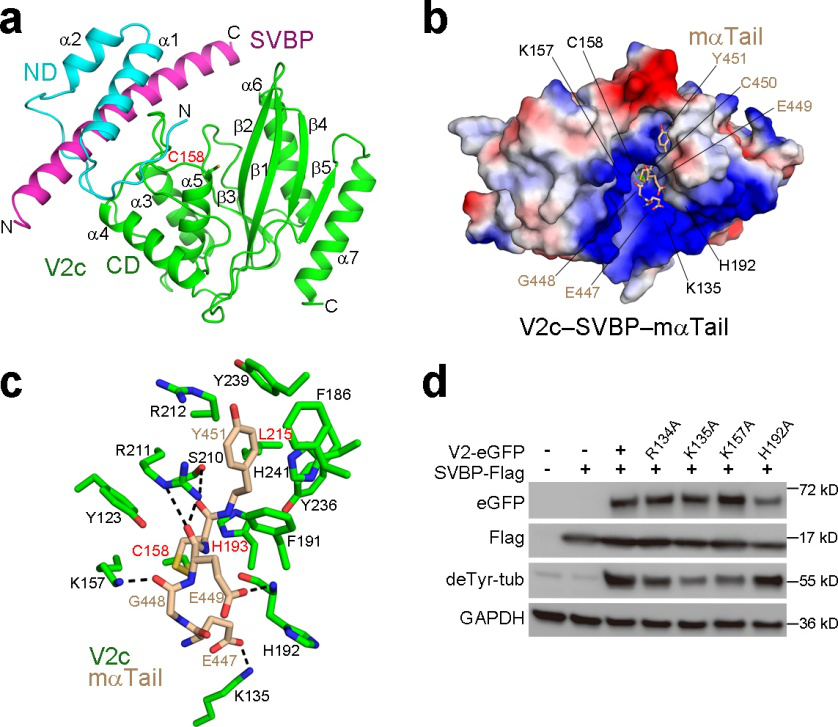
图: (a) VASH2-SVBP复合物的整体结构(卡通模型),绿色为VASH2,紫色为SVBP蛋白;(b) VASH2-SVBP(显示为静电表面模式)和a微管蛋白C末端小肽(显示为球棍模型)的复合物结构;(c) VASH2-SVBP和a微管蛋白C末端小肽的相互作用;(d) 检测VASH2关键氨基酸突变体的催化活性。
起始微管蛋白“酪氨酸化-去酪氨酸化”循环的是微管蛋白酪氨酸羧肽酶,而最新的研究发现在哺乳动物中VASH1或VASH2两个同源蛋白和其辅助因子SVBP形成的异二聚体可以行使该羧肽酶功能。但是该羧肽酶如何催化微管蛋白去酪氨酸化的分子机理此前尚不清楚。
在此项研究中,生物系黄鸿达课题组博士后汪娜等解析了VASH2-SVBP复合物的晶体结构,并且通过生化和细胞实验证明SVBP不仅能够帮助VASH2进行正确的表达和折叠,而且对于VASH2进行a-微管蛋白C末端去酪氨酸化的功能也起到至关重要的作用。团队还获得了VASH2-SVBP与两种抑制剂(epoY和TPCK)的复合物晶体结构,阐明了这些抑制剂的抑制机理。此后,团队进一步解析了VASH2-SVBP与a-微管蛋白C末端的复合物晶体结构,揭示了VASH2-SVBP与a-微管蛋白C末端的结合模式,并结合生化实验和神经细胞发育实验揭示了VASH2-SVBP与微管纤维的相互作用界面。研究成果阐明了VASH2-SVBP进行a-微管蛋白C末端去酪氨酸化的结构基础以及其在神经细胞发育中的重要作用,为今后小分子抑制剂的研发提供了结构基础。
该项研究由黄鸿达课题组与Grenoble Institut Neurosciences的Marie-Jo Moutin博士以及瑞士Paul Scherrer Institut的Michel O. Steinmetz教授团队合作完成。南方科技大学生物系为第一通讯单位,黄鸿达课题组博士后汪娜为该文章的共同第一作者。
(论文链接:https://www.nature.com/articles/s41594-019-0241-y)
近期,黄鸿达课题组还和中国科学技术大学生命学院教授许超课题组等合作,揭示了VASH1-SVBP进行微管蛋白C末端去酪氨酸化的结构基础,以及VASH1-SVBP在细胞分裂中的重要作用。汪娜为该文章的共同第一作者。该研究论文近日在Cell Research杂志在线发表。
(论文链接:www.nature.com/articles/s41422-019-0187-y)。
两项研究的所有晶体数据均采集于上海光源19U/18U/17U线站。研究得到了国家科技攻关计划,深圳市孔雀计划B类的支持。
供稿:汪娜
图片:汪娜、学校宣传部
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09