南科大生科院杜嘉木课题组与闫凯歌课题组合作揭示染色质重塑酶DDM1调控植物DNA甲基化的作用机制
日期:2024-02-29
近日,南方科技大学生命科学学院生物系杜嘉木课题组与化学生物系闫凯歌课题组合作在Nature Plants杂志上在线发表了题为“Molecular basis of chromatin remodelling by DDM1 involved in plant DNA methylation”的研究论文。该研究综合运用生物化学、结构生物学等手段解析了三种不同功能状态的DDM1-核小体(NCP)的冷冻电镜结构,揭示了DDM1参与染色质重塑全过程的构象变化和分子机制,加深了人们对染色质重塑酶DDM1调控植物DNA甲基化作用机理的认识。
DNA甲基化是一种重要的表观遗传学标记,在基因调控层面主要负责基因沉默,能维持基因组的稳定性和完整性,在基因组印记、转座子抑制和基因活性调控等方面起重要作用。然而,细胞内的DNA以核小体为单位,形成高度折叠压缩的染色质结构,阻碍了DNA甲基转移酶的靠近,同时也影响了DNA复制、转录、修复、重组等重要细胞生理过程。DDM1(DECREASE IN DNA METHYLATION 1)是维持植物DNA甲基化的重要调控因子,属于SWI/SNF家族的染色质重塑酶,能够利用ATP水解产生的能量重塑核小体,游离出DNA,提高其对下游因子的可接近性。尽管DDM1功能明确,但对其如何利用ATP水解的能量推动核小体DNA滑动依然未知。
研究人员通过加入不同的小分子核酸底物(ADP, ADP-BeFx),模拟处于不同重塑反应阶段的DDM1-NCP复合物,利用单颗粒冷冻电镜的技术方法,分别解析了Apo态,ADP-BeFx结合态及ADP结合态的DDM1-NCP复合物的三维分子结构。以ADP结合态的复合物结构为例,结合体外生化实验,研究人员确定了DDM1锚定核小体的相互作用界面和关键氨基酸位点。DDM1的两个结构域——ATP酶催化结构域(Lobe1)和解旋酶结构域(Lobe2)像钳子一样在SHL2位夹住核小体,结合界面上,DDM1由众多碱性氨基酸通过静电相互作用与DNA酸性磷酸骨架产生广泛的互作。另外,有意思的是,DDM1通过Lobe2结构域上的一小块酸性区域锚定核小体H4组蛋白的碱性尾巴,进一步加强了两者的互作。小分子核酸底物如ADP则通过疏水互作、氢键等作用力结合在两催化结构域的裂隙中,以便于与催化核心的结合或解离。体外氨基酸单点突变酶活实验进一步验证了这些位点的重要作用。
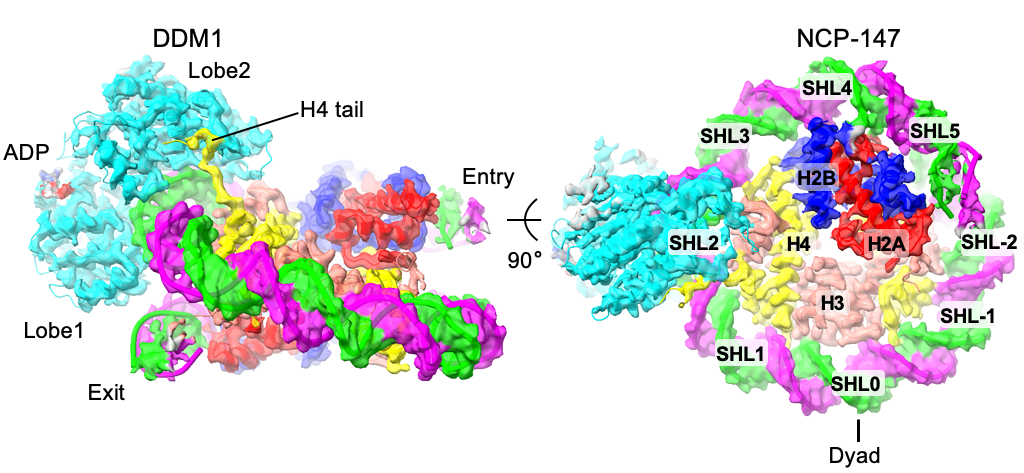
图1.DDM1核小体复合物的结构
研究人员通过对三种不同功能状态的DDM1-NCP复合物的三维结构对比分析后,发现在一个ATPase循环过程,即Apo态,ADP-BeFx结合态及ADP结合态,再次回到无核苷酸结合的Apo态的过程中,随着底物ATP结合到水解,最后到释放,DDM1经历了开放-闭合-打开的构象变化,同时带动了DNA从入口端到出口端的滑动。根据以上实验结果,研究人员提出了DDM1水解ATP重塑核小体的工作模型:首先,DDM1结合核小体后诱导DNA产生形变,开放状态的DDM1从出口端拉动DNA产生波动,并将其储存在SHL2位;ATP结合诱导DDM1裂隙闭合,推动“DNA波”往出口端迁移;接着ATP水解再次打开了DDM1分子,重新将“DNA波”储存在SHL2位,ADP释放后DDM1再次回到无核苷酸结合的Apo态,等待下一次的ATPase循环过程。这个模型将ATP水解、DDM1构象变化与DNA滑动相偶联,同时也解释了DNA移动的方向性机制。总之,本研究揭示了植物染色质重塑酶DDM1推动核小体DNA移位的动态过程和基本原理,有助于人们对染色质重塑酶DDM1调控植物DNA甲基化作用机理的深入了解。
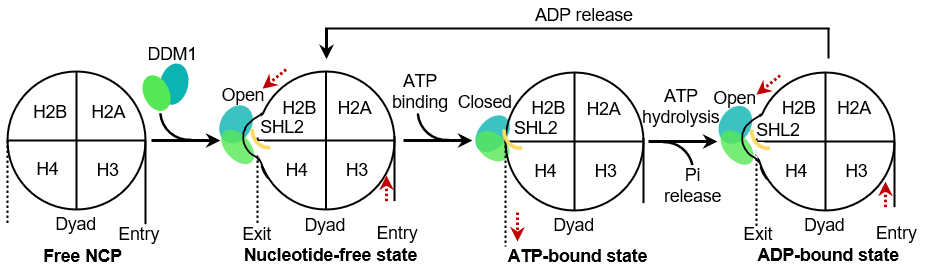
图 2. DDM1介导染色质重塑的机制
南方科技大学生命科学学院博士生刘悦、博士后张智慧为本文的共同第一作者,杜嘉木教授和闫凯歌助理教授为论文共同通讯作者,南方科技大学是论文第一单位。南方科技大学生命科学学院副教授黄鸿达参与了课题讨论与支持,英国MRC分子生物学实验室博士后胡泓淼、上海植物逆境生物学研究中心陈薇、南方科技大学生命科学学院章钒、王倩、王昌仕参与了课题研究。该工作得到了国家自然科学基金、深圳市科技创新委员会和欧洲分子生物学组织(EMBO)博士后基金的支持,南方科技大学冷冻电镜中心和分析测试中心分别为本课题的冷冻电镜数据采集和色谱实验提供了大力支持。
论文链接:https://www.nature.com/articles/s41477-024-01640-z
供稿:生命科学学院杜嘉木课题组
编辑:付文卿
审核:万峻
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
