南科大生科院靳文菲团队发现髓系细胞受体Sirpa不依赖CD47调控肿瘤免疫逃逸
日期:2024-01-18
近日,南方科技大学生命科学学院副教授靳文菲团队联合中山大学教授陈俊团队在Nature Cancer上发表了题为“Sirpα on tumor-associated myeloid cells restrains anti-tumor immunity in colorectal cancer independent of its interaction with CD47”的研究论文。该研究通过大规模的单细胞测序数据分析发现细胞表面受体Sirpa在肿瘤相关髓系细胞中特异性高表达并与癌症患者预后呈负相关。发现Sirpa缺失重塑了肿瘤微环境,诱导产生了抗肿瘤活性强的TAM_Ccl8hi和gMDSC_H2-Q10hi等髓系细胞亚群,并通过Syk/Btk激酶依赖的Ccl8分泌促进T细胞募集。研究表明Sirpα敲除与抗PD-L1的联合治疗更好的抑制了肿瘤发展,意味着Sirpa阻断有望成为实体肿瘤免疫治疗的新靶点。

恶性肿瘤是全球主要致死疾病之一。虽然靶向耗竭 T 细胞的免疫检查点阻断疗法如抗PD-1/PD-L1在部分癌症患者中取得显著疗效,但对大多数实体瘤的治疗效果仍然有限。主要原因在于复杂的免疫抑制性肿瘤微环境影响了免疫治疗的效果。该研究通过分析超过52万个结直肠癌患者的单细胞转录组数据(主要取自公共数据)刻画肿瘤微环境,发现肿瘤相关巨噬细胞(TAMs)和粒细胞样髓源性抑制细胞(gMDSCs)在肿瘤组织中显著富集,且在所有免疫细胞中呈现出最强的免疫抑制性,同时高表达含免疫受体酪氨酸抑制基序(ITIM)的免疫受体如SIRPA。研究团队建立基因敲除小鼠模型进一步探索SIRPA缺失对肿瘤的影响,发现Sirpa敲除小鼠的结直肠癌皮下模型和自发模型中肿瘤进展均被显著抑制。对临床数据分析发现Sirpa的表达水平与多种实体肿瘤患者预后呈负相关。这些结果均提示Sirpa与肿瘤发展密切相关,Sirpa缺失显著抑制多种实体肿瘤的发展。
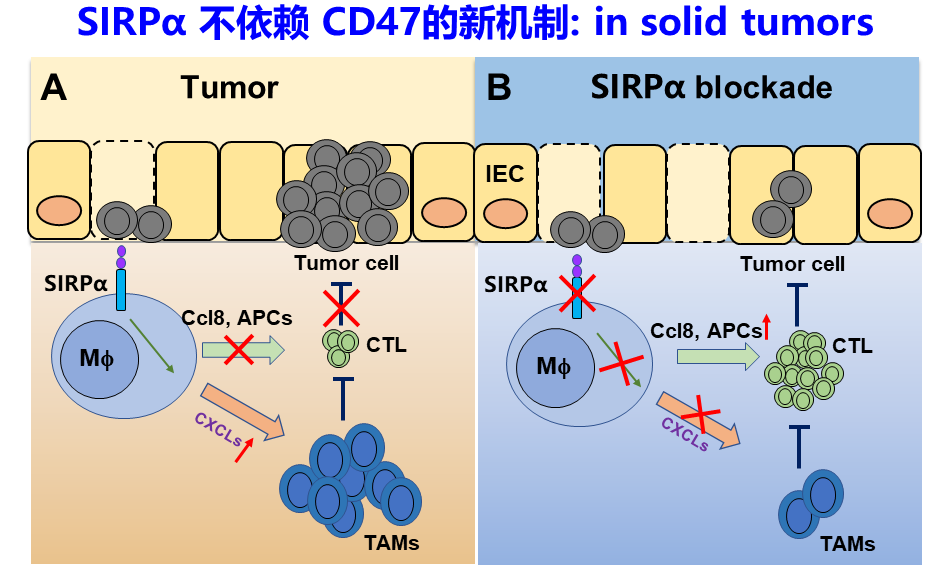
图1.SIRPa缺失重塑肿瘤微环境,增强巨噬细胞的功能并通过分泌Ccl8招募 T细胞杀伤肿瘤
肿瘤细胞表面的CD47与髓系细胞表面受体Sirpa结合,促进Sirpa上的免疫受体酪氨酸抑制基序(ITIM)发生磷酸化,从而阻断吞噬作用,促进肿瘤免疫逃逸。虽然CD47-Sirpa 信号通路(也被称为“别吃我”信号和吞噬检查点)是巨噬细胞上非常有潜力的免疫治疗靶点。但CD47缺失或CD47阻断对肿瘤发展的抑制比Sirpa缺失要弱很多,这意味着Sirpa存在着不依赖于与经典配体CD47相互作用而促进肿瘤免疫逃逸的其他信号通路。进一步分析发现发现Sirpa敲除的TAM和gMDSCs具有更强的抗原呈递能力和细胞吞噬能力,产生了抗肿瘤活性强的TAM_Ccl8hi和gMDSC_H2-Q10hi亚群。Sirpa敲除促进T细胞的活化与增殖,从而重塑TIME使其呈现出更强的抗肿瘤作用。体外实验表明,Sirpa敲除的巨噬细胞可通过Syk/Btk激酶依赖的Ccl8分泌而促进T细胞募集发挥抗肿瘤作用。此外,研究人员发现Sirpα缺失与抗PD-L1的联合治疗呈现出更强的肿瘤抑制效果。
综上所述,靶向Sirpa可以同时调节天然免疫和适应性免疫,重塑肿瘤免疫微环境使其呈现出更强的抗肿瘤免疫效应,从而阻止实体肿瘤的进展。Sirpa阻断有望成为实体肿瘤免疫治疗的新靶点,攻克实体肿瘤免疫治疗耐受的困境。

图2.SIRPa缺失招募 T细胞杀伤肿瘤的拟人化艺术图
中山大学黄春柳、南方科技大学生命科学学院博士生王雪飞、中山大学附属第一医院王颖钊为该论文共同第一作者,靳文菲、陈俊、中山大学附属第一医院何伟玲教授及南方科技大学洪旎研究助理教授为论文共同通讯作者。该研究得到国家重点研发计划、国家自然科学基金、省重点研发、市重点等项目资助。中山大学蔡卫斌教授、广州医科大学廖静教授、中山大学附属第五医院陈守登研究员、深圳市人民医院李阳博士参与了该研究。
论文链接:https://www.nature.com/articles/s43018-023-00691-z
供稿:生命科学学院
通讯员:付文卿
最新动态
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
-
生命科学学院党委召开2025年度党组织书记抓基层党建工作述职评议会议
Date:2026-01-08
-
国家自然科学基金卓越研究群体项目(原基础科学中心项目)“神经系统疾病致病机理的研究和干预”年度交流会在深圳召开
Date:2026-01-08
-
南科大生科院《生物化学I(生物大分子)》课程入选国家级一流本科课程
Date:2026-01-05
