南科大医学院贾宁课题组与生命科学学院黄鸿达团队揭示细菌IV-A型CRISPR-Csf防御系统作用机制
日期:2023-07-10
近日,南方科技大学医学院生物化学系贾宁副教授课题组与生命科学学院黄鸿达副教授课题组合作,于2023年6月20日在Molecular Cell在线发表了题为“Type IV-A CRISPR-Csf complex: assembly, dsDNA targeting and CasDinG recruitment”的研究论文。该研究通过运用生物化学、结构生物学以及微生物学等手段揭示了细菌利用IV-A型CRISPR-Csf免疫防御系统抵御外源质粒入侵的分子机制,为将其开发成新型基因编辑工具奠定了坚实的理论基础,或可用于日益严重的耐药菌感染的治疗。

细菌和古细菌的CRISPR-Cas免疫系统因其精准靶向识别DNA/RNA的特性被开发为基因编辑工具,并广泛应用于生命科学及医学领域。贾宁课题组一直聚焦于细菌和古细菌免疫防御系统抵御噬菌体和质粒入侵的分子机制研究,近6年来揭示了多种原核生物CRISPR-Cas防御系统抵御噬菌体和质粒入侵的分子机制(Molecular Cell, 2019a, 2019b, 2019c, 2023; Nature Communications, 2022; Science, 2020; Cell Research, 2020, 2022; Nature Reviews Molecular Cell Biology, 2021)。目前已被鉴定的CRISPR-Cas系统共包含六种类型(I-VI),其中仅有IV型CRISPR-Csf系统的功能机制至今仍是一个谜题。
值得关注的是,IV型CRISPR-Csf系统与其他类型明显不同,该系统大多存在于质粒而非染色体上,与耐药基因相关联。IV型CRISPR-Csf系统又可分为IV-A至IV-E五种亚型。目前已有研究推测,IV-A型CRISPR-Csf系统很可能通过靶向清除外源入侵的质粒,来参与质粒之间的竞争。因此,CRISPR-Csf系统或可用于对抗携带耐药基因质粒的转移,从而对抗日益严重的耐药菌传播,但其发挥作用的分子机制尚不清楚。
为了探究细菌IV-A型CRISPR-Csf抵御质粒入侵的作用机制,该研究组首先共同表达了铜绿假单胞菌Pseudomonas aeruginosa PA83中IV-A CRISPR-Csf系统基因座上的5个基因以及CRISPR array。发现Csf1, Csf2, Csf3 和Csf5 与crRNA形成复合物(该复合物称为CsfcrRNA),但是Csf4(CasDinG)并不与其形成复合物。接着通过生化实验证明CsfcrRNA可特异性识别靶dsDNA,并通过冷冻电镜单颗粒方法解析了CsfcrRNA及与靶dsDNA结合复合物的冷冻电镜结构,揭示了IV-A型CRISPR-Csf系统的组装、crRNA的成熟以及靶dsDNA识别的分子机制(图1)。
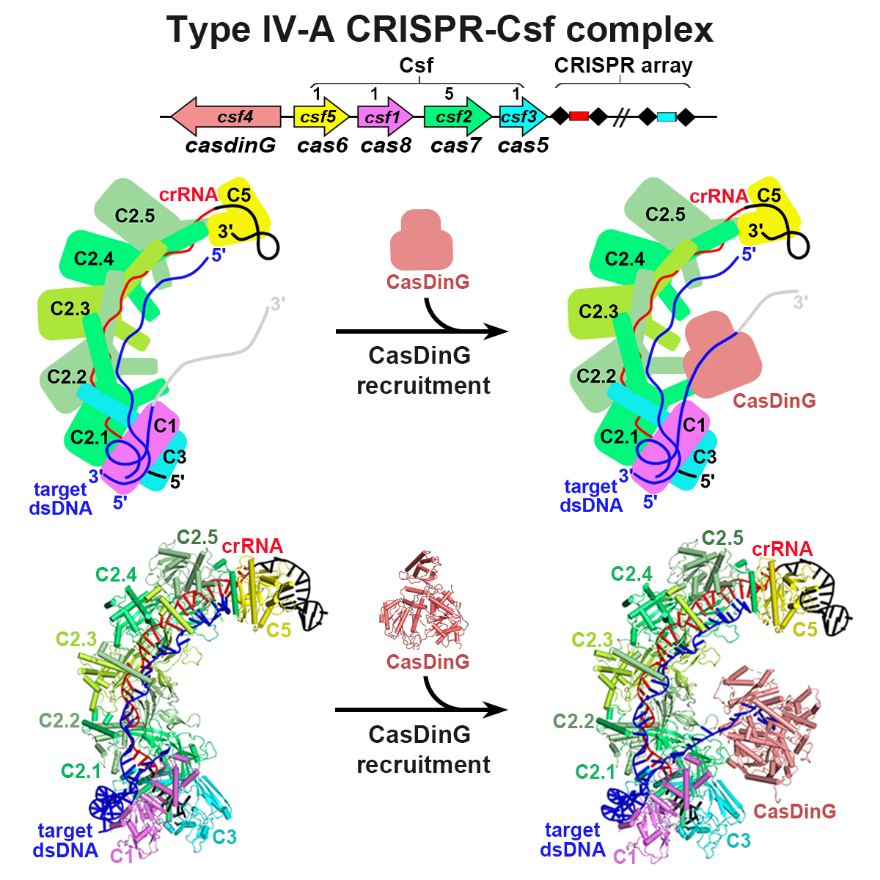 图1. IV-A型CRISPR-Csf复合物的组装以及靶标dsDNA的识别
图1. IV-A型CRISPR-Csf复合物的组装以及靶标dsDNA的识别
研究人员过结构分析和生化实验进一步发现,相比于I型、II型及V型CRISPR系统,IV-A型系统识别“DWN”(简并碱基D代表A/T/G,W代表A/T,N代表A/T/C/G)PAM位点,识别dsDNA的范围更广。因此,研究人员推测IV-A型系统可能利用“反靶向”机制,通过排斥不偏好的序列(例如CRISPR array中的自身序列)来区分自我和非我DNA。这种广泛的DNA识别特性使得IV-A型CRISPR-Csf系统作为一种新型基因编辑工具,具有更广泛的应用价值。
此外,虽然CasDinG不与CsfcrRNA形成复合物,但是细菌体内实验表明CasDinG在IV-A型CRISPR-Csf系统抵御外源质粒入侵过程中发挥着必不可少的作用。为了探究CasDinG在IV-A型CRISPR-Csf系统中的作用,研究人员通过X-ray晶体学技术解析了一系列CasDinG的结构,并通过结构分析和生化实验发现CasDinG是一种依赖ATP的5′-3′ DNA解旋酶。
为了进一步探究CasDinG解旋酶在IV-A型CRISPR-Csf系统的作用,研究人员首先通过生化实验证实,CasDinG虽然不能结合CsfcrRNA二元复合物,但是可以被CsfcrRNA-dsDNA三元复合物招募,形成稳定的CasDinG-CsfcrRNA-dsDNA四元复合物(图1)。并且研究人员通过生化实验发现CasDinG在ATP存在的条件下,可将靶dsDNA从CsfcrRNA-dsDNA复合物中解旋下来。
而为了进一步探究CasDinG与CsfcrRNA-dsDNA复合物的作用机制,研究人员利用冷冻电镜解析了~3 Å CasDinG-CsfcrRNA-dsDNA的结构,并观察到了两种不同的状态。研究人员发现,在不同的状态中,CasDinG能够与不同的Csf2亚基相互作用,这暗示着CasDinG可能沿着Csf2亚基滑动来解开靶dsDNA。在这个过程中,被解旋的单链DNA很可能被细胞中的DNA酶所降解,从而导致目标质粒被降解。
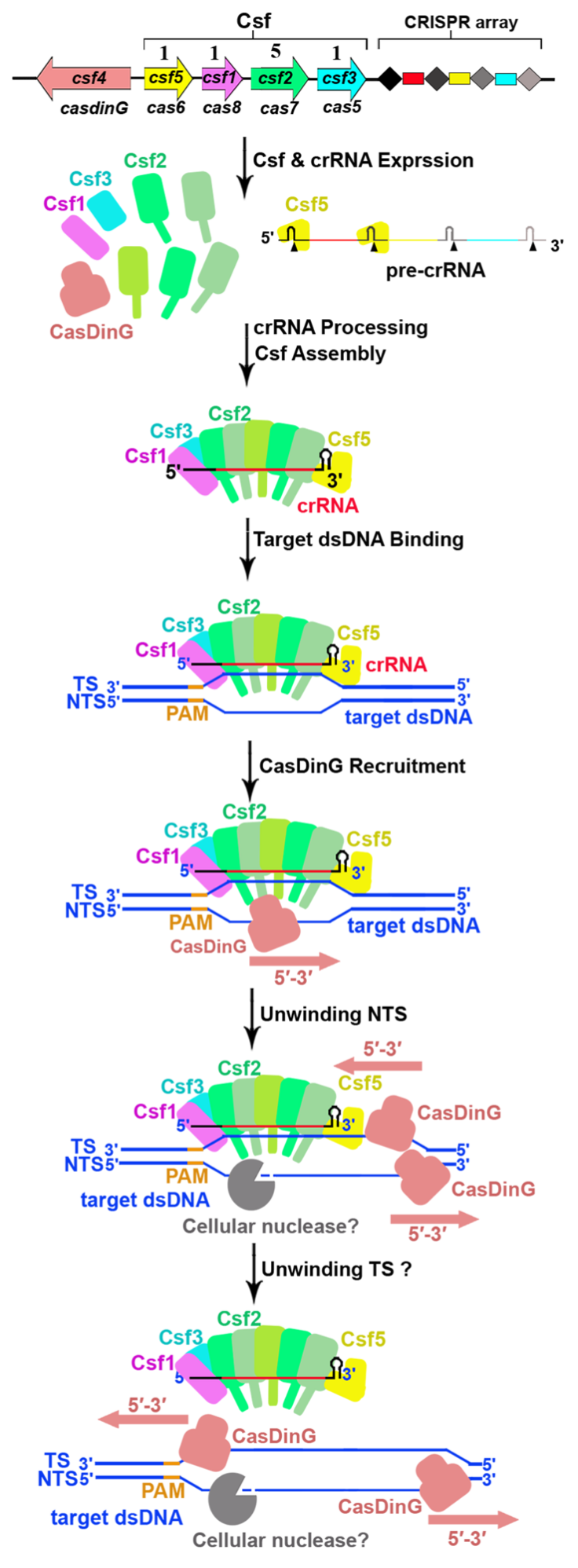
图2. IV-A型CRISPR-Csf复合物靶向dsDNA的分子机制
综合以上研究结果,研究人员提出了IV-A型CRISPR-Csf复合物组装、靶向dsDNA、招募CasDinG蛋白及dsDNA解离等过程的模型(图2),详细阐述了IV-A型CRISPR-Csf系统在抵御质粒入侵过程中靶向dsDNA的分子机制,以及细菌如何利用该系统抵御质粒入侵的分子机制。
虽然IV-A型CRISPR-Csf复合物组成复杂,但编码该系统的基因(3,159 bp)比spCas9(4,104 bp)更小,PAM识别位点也更广泛,是极具潜力的新型基因编辑工具,研究人员针对此部分内容也申请了相关专利。
该研究揭示了目前最为神秘的IV型CRISPR-Csf系统复合物的组装、靶向dsDNA和招募CasDinG的分子机制,不仅加深了该领域对IV型CRISPR-Csf系统在抵御质粒入侵分子机制的理解,也为将其开发成新型CRISPR基因编辑工具提供了坚实的理论基础,或可用于对抗日益严重的多重耐药型细菌感染乃至服务于整个生物医疗领域。
南方科技大学医学院博士后崔宁、张峻涛为本论文的共同第一作者。南方科技大学医学院生物化学系贾宁副教授和南方科技大学生命学院黄鸿达副教授为本论文的共同通讯作者。南方科技大学是论文第一单位和通讯作者单位。该研究得到了国家自然科学基金、广东省和深圳市面上自然基金、广东省重点实验室等项目的大力支持。南方科技大学冷冻电镜中心为该研究相关的冷冻电镜数据收集和处理工作提供了大力支持。
论文链接:https://doi.org/10.1016/j.molcel.2023.05.036
通讯员:廖丹
供稿单位:医学院
主图:丘妍
编辑:韩文嘉
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
