南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
日期:2026-02-05
近日,南方科技大学系统生物学系曾福星副教授与伊利诺伊大学厄巴纳—香槟分校Raven H. Huang教授合作在阐明细菌如何拯救蛋白质合成过程中发生停滞的核糖体方面取得了重要进展,并将研究成果发表于国际期刊Science Advances。该研究揭示了一类蛋白释放因子同源物(PrfH)亚家族的分子机制与结构基础。该亚家族不仅能够拯救受损的停滞核糖体,也可作用于结构完整的停滞核糖体,从而重新定义了人们对细菌翻译质量控制机制的认识。
蛋白质合成是生命活动的核心过程,但核糖体在翻译过程中常常会遇到障碍,例如 mRNA 截断或由核糖体毒素引起的 RNA 损伤,从而导致翻译停滞并可能引发致命的细胞应激反应。尽管诸如trans-translation及其他替代性核糖体拯救因子等经典途径已被广泛研究,但这些因子如何识别并解决更广泛类型的停滞核糖体,其作用机制长期以来仍不清楚。
在本研究中,研究人员聚焦于一个此前尚未被系统表征的 PrfH 亚家族,结合生化实验与高分辨率冷冻电镜(cryo-EM)技术,解析了该因子在不同翻译停滞状态下与核糖体的相互作用方式。研究发现,来源于 Capnocytophaga gingivalis 的 PrfH(CgPrfH)不仅能够催化核糖体毒素损伤核糖体上的肽链释放,还可在结构完整但发生停滞的核糖体上发挥同样的作用,展现出一种出乎意料的双重活性,显著拓展了核糖体拯救因子的功能范畴。
对 CgPrfH 分别结合于受损和完整 70S 核糖体的冷冻电镜结构分析表明,该因子通过不同蛋白区域介导的差异化识别模式与核糖体相互作用。在两种复合物中,PrfH 均能将其保守的 GGQ 基序准确定位至肽酰转移酶中心以催化肽链释放,但其实现方式依赖于针对不同停滞状态而形成的结构特异性相互作用。这些结果阐明了单一因子如何适应多样化的核糖体环境(图1)。本研究整合了生物信息学分析、体外生化实验以及结构生物学手段,构建了一个连贯的模型,用以解释该 PrfH 亚家族在细菌翻译质量控制中的作用机制。除了深化我们对核糖体生物学基本原理的理解外,这一成果还对解析细菌应激反应具有重要意义,并可能为未来以核糖体拯救通路为靶点的抗菌策略提供理论依据。
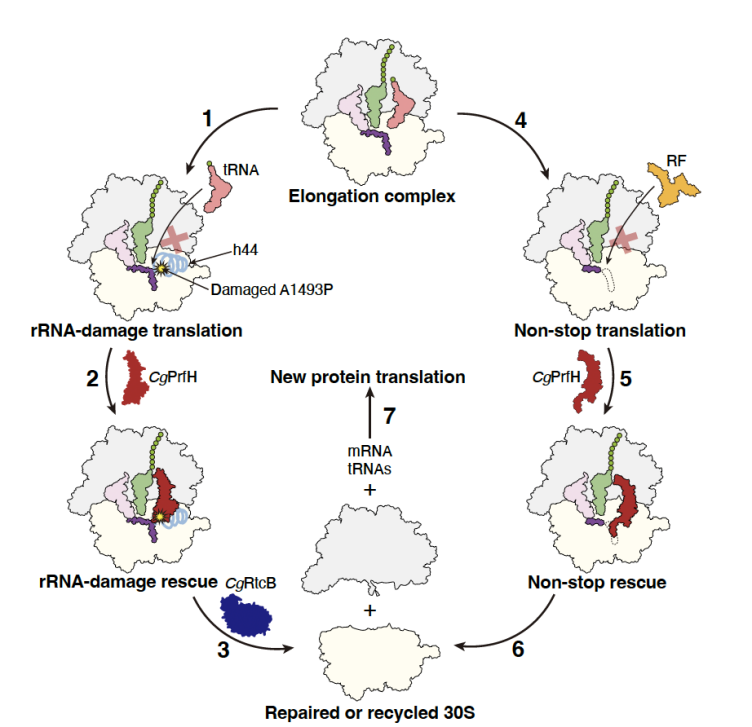
图1、CgPrfH通过两种机制识别并拯救不同的停滞核糖体
曾福星实验室博士后、伊利诺伊大学厄巴纳—香槟分校已毕业博士生田雁南和曾福星实验室博士生李青嵘,是文章的共同第一作者。曾福星与Raven H. Huang为共同通讯作者。本文冷冻电镜结构解析得到南方科技大学高分辨生物电镜结构研究院、冷冻电镜中心的大力支持。
文章链接:https://www.science.org/doi/10.1126/sciadv.aea7378
图文:曾福星
编辑:付文卿
审核:万 峻
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
