南科大生科院刘忠民团队揭示了人源SPCA1蛋白转运钙离子的工作机制
日期:2023-06-01
近日,南方科技大学生命科学学院助理教授刘忠民课题组联合浙江大学生命科学学院王勇研究员团队在学术期刊Cell Research上在线发表了题为“Structure and transport mechanism of the human calcium pump SPCA1”的研究论文。该研究解析了人源SPCA1蛋白 (hSPCA1) 几乎完整的底物转运过程,揭示了全新的钙离子转运机制(图1)。
钙离子(Ca2+)是细胞中最丰富的信号分子之一。Ca2+调节许多细胞功能,包括增殖、分化、凋亡、分泌、收缩和受精等。高尔基体作为Ca2+储存的关键细胞器之一,参与调节Ca2+稳态和随后的细胞内Ca2+信号传导。此外,高尔基体中合适的Ca2+浓度对正常的蛋白质合成、加工和分选至关重要。
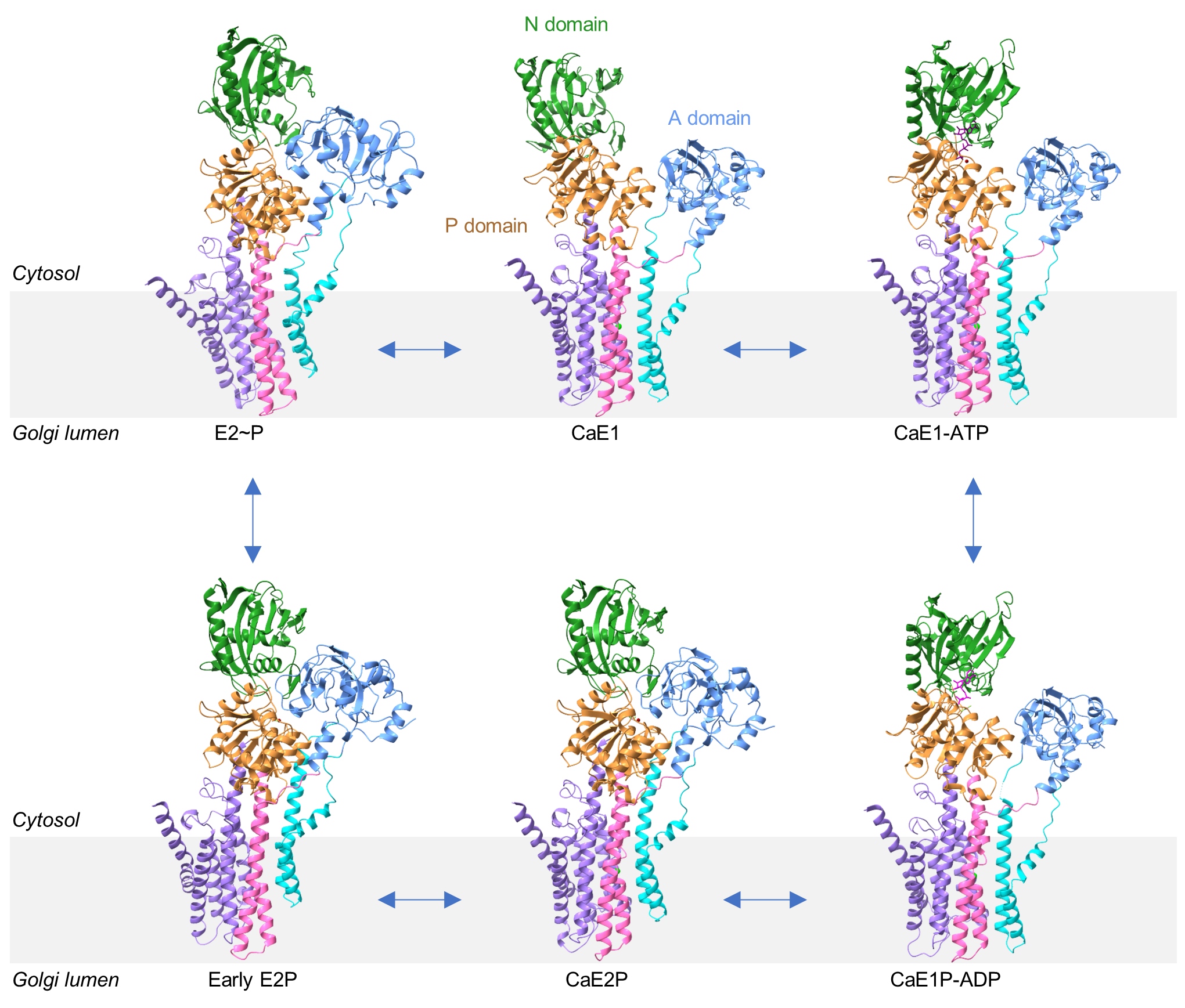
图1 hSPCA1转运底物过程中六个中间态的原子模型
SPCA1主要定位于高尔基体膜上,对维持高尔基体的正确结构和功能起重要作用。SPCA1属于P-type IIA ATPases家族,利用ATP水解释放的能量将Ca2+从细胞质基质泵入高尔基体腔,转运Ca2+过程遵循典型的Post-Albers循环。研究表明,SPCA1功能失常可能会引发Hailey-Hailey disease (HHD, 家族性良性慢性天疱疮)和乳腺癌的发生。因此,深入研究hSPCA1介导的Ca2+转运机理具有重要的生物医学意义。
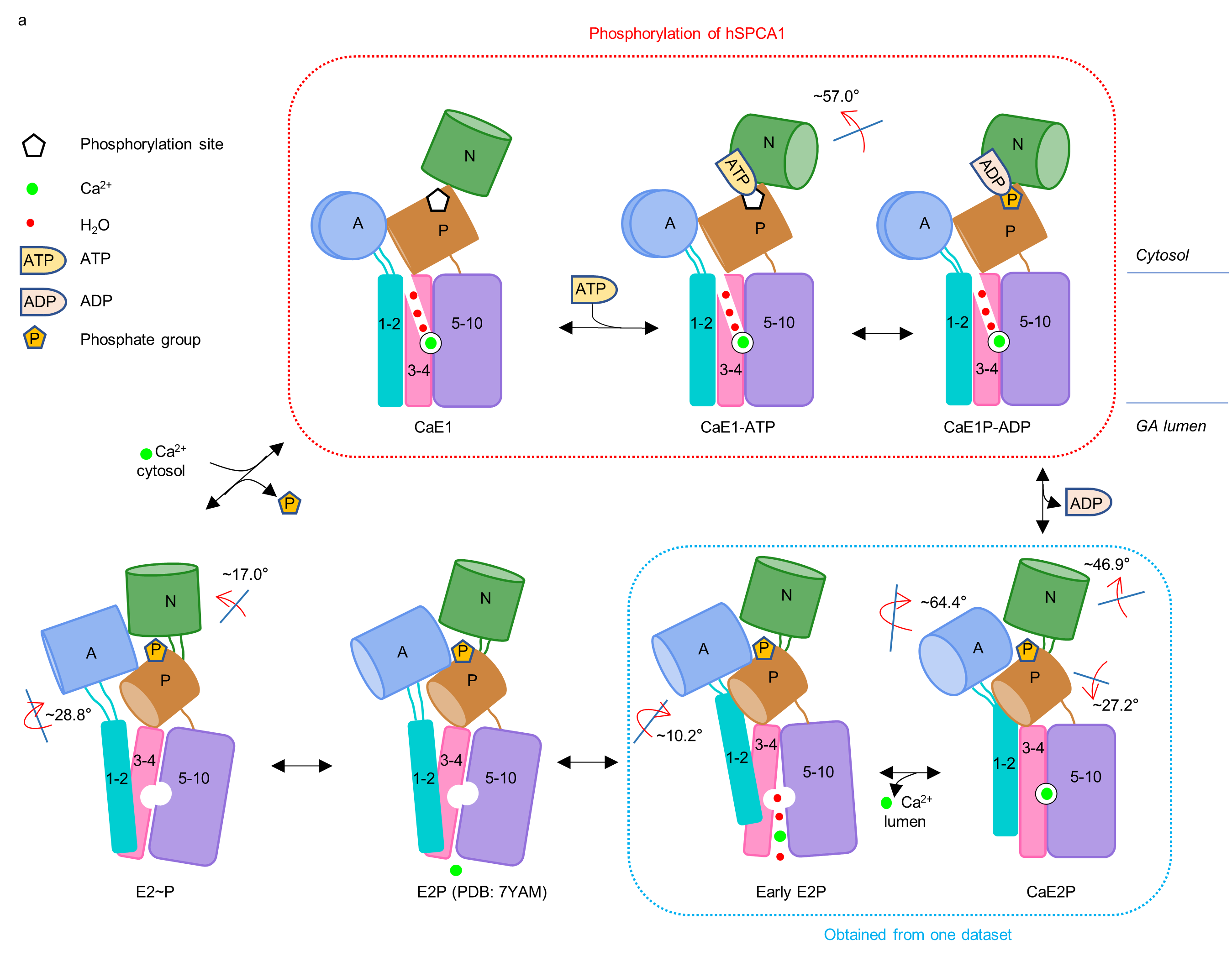
图2 hSPCA1转运Ca2+的工作模型
本项研究通过外源重组表达高质量的hSPCA1蛋白,利用冷冻电镜单颗粒技术成功解析了hSPCA1在Ca2+转运过程中的6个中间状态,几乎覆盖完整的 Post-Albers转运循环。研究人员发现,与其他P-type ATPases不同的是,在磷酸化过程中, hSPCA1的Ca2+进入通道保持开放状态(图2)。本研究明确了hSPCA1结合Ca2+的分子机制,同时还阐明了与经典Ca2+转运蛋白SERCA差异性的结构基础。另外,本研究首次获得了CaE2P状态的结构,为研究其他P-type II ATPase(比如:SERCA, PMCA)提供了重要结构信息。更有趣的是,本研究通过电镜三维分类分析,获得了early E2P结构,该结构呈lumen-open的构象,暗示着这个结构处于Ca2+释放的状态。基于六个不同构象的hSPCA1高分辨率三维结构,研究人员应用分子动力学模拟(MD)明确了Ca2+进入和离开hSPCA1的完整途径。综上,该研究通过结构生物学、分子动力学模拟等技术手段,全面揭示了hSPCA1转运Ca2+的工作机制,为治疗hSPCA1相关的疾病提供理论基础和重要线索。
南方科技大学生命科学学院硕士研究生武梦琪、吴藏,和浙江大学生命科学学院拟录取博士研究生宋铁峰为本论文共同第一作者,刘忠民和浙江大学生命科学学院的王勇为本文共同通讯作者。南方科技大学为论文第一单位。冷冻电镜数据收集和处理得到了南方科技大学冷冻电镜中心和水木未来的支持。hSPCA1活性相关实验得到了香港中文大学生物医学学院潘克武的支持。该工作得到了国家自然科学基金、深圳市科创委的资助。
论文链接:
https://doi.org/10.1038/s41422-023-00827-x
供稿:刘忠民课题组
编辑:付文卿
审核:万峻
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
