南科大隋森芳院士团队解析近原子分辨率的酵母核孔复合物内环结构
日期:2022-04-06
近日,南方科技大学生命科学学院、冷冻电镜中心隋森芳院士团队在Cell Research在线发表了题为“Near atomic structure of the inner ring of the Saccharomyces cerevisiae nuclear pore complex”的最新研究成果,报道了近原子分辨率的酵母核孔复合物内环(Inner ring,IR)结构。

真核生物和原核生物最主要的区别在于真核生物进化出了独立的细胞核。细胞核由双层膜(核膜)包裹,膜的存在使得细胞的核质交流受到阻碍。核孔复合物(nuclear pore complex,NPC)是镶嵌在双层核膜上,控制核质与胞质间物质运输的唯一通道,其功能的紊乱会引起包括癌症在内的多种严重疾病。70余年来,科学家们一直致力于解析NPC的高分辨率结构,然而由于其结构内在的柔性、组成的复杂以及体积的庞大,至今仍无法全面阐释其精确构成。
NPC是细胞内体积最大、结构最复杂的蛋白质机器,从酵母到人源细胞,NPC由来自30多种不同核孔蛋白的约550-1000个蛋白分子组成,相对分子质量在60-120 MDa左右。NPC具有三明治的结构特征,包括四个同轴的环状结构:位于胞质侧的外环(Cytoplasmic ring,CR)和核质侧的外环(Nuclear ring,NR),位于两层外环之间的内环IR,穿插于双层核膜内部的腔环(Lumen ring,LR)。IR同时与其他三个环相连,是NPC中最核心的结构。IR具有C8的对称性,每一个单元称为IR monomer,且每个IR monomer又具有近似C2的对称性,每个部分称为IR protomer。该研究以酿酒酵母为研究对象,综合运用生物化学、细胞生物学和冷冻电子显微学的手段成功获得了IR monomer和IR protomer的高分辨率结构,分辨率分别为3.73 Å和3.71 Å,同时还获得几个重要的IR亚基的结构,最终成功搭建了完整IR的原子模型,这是目前为止酵母NPC的IR最详尽、最精确的结构模型(图1)。
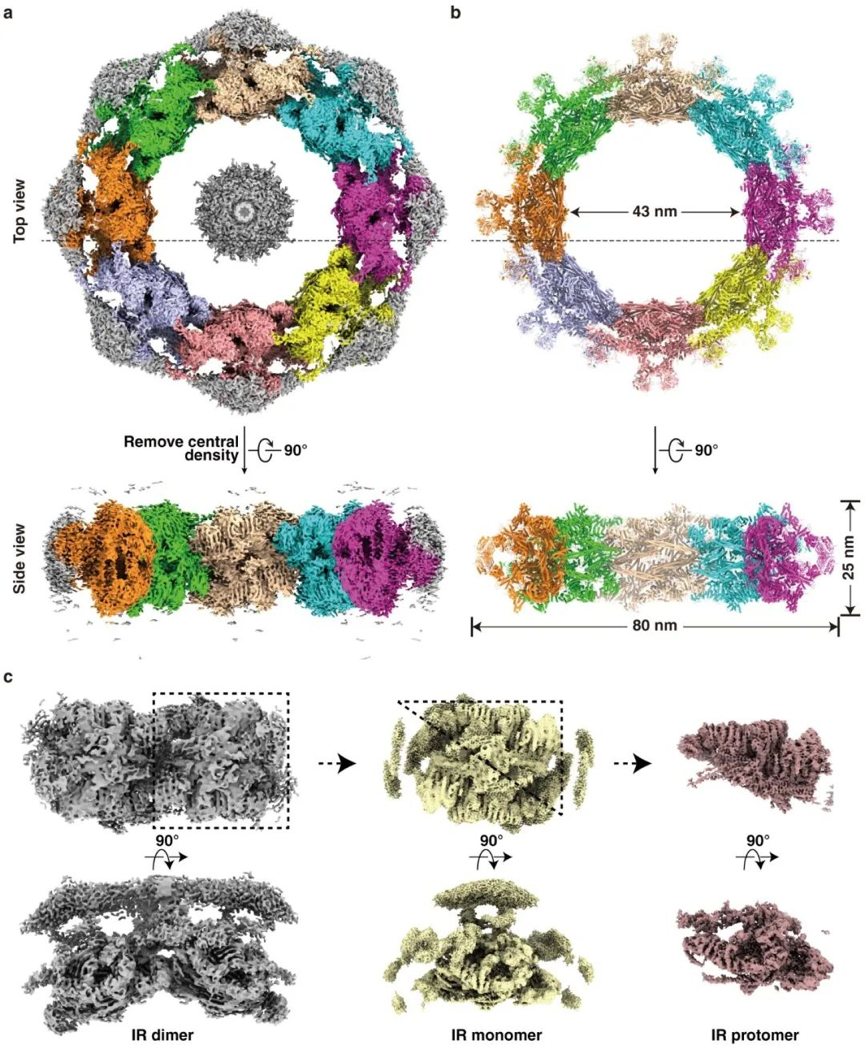
图1. 酵母NPC中IR的冷冻电镜结构完整IR的冷冻电镜结构(a)及其原子模型(b);(c)IR dimer、IR monomer和IR protomer的冷冻电镜结构
该模型成功搭建了192个蛋白分子,分子量约为16 MDa,约占酵母核孔复合体质量的三分之一。每个IR monomer由三层结构组成:外层、中间层和内层。其中外层中的Nup157和Nup170的N端靠近核膜,介导了IR与LR之间的相互作用;中间层“Z”字形的Nup188和Nup192形成了一个近70°的弧形凹槽用于容纳内层菱形的CNT tetramer。每个CNT tetramer内部包含8个铰链结构,8个CNT tetramer形成了NPC最内层感知物质运输的结构,这种特殊的结构特征能够为不同体积物质的运输提供结构上的可变性。结构分析显示在IR monomer内部存在大量的柔性的相互作用,相比之下,IR monomer之间的相互作用则较弱。通过与先前发表的原位的结构比较发现,该研究获得的NPC处于“收缩状态”,相邻的IR monomer间依靠上述几对较弱的相互作用维持;而原位的结构则处于“伸展”状态,相邻的IR monomer被“拉开”,产生了一个近7nm的“沟”,IR monomer内部由于大量相互作用的存在而整体保持相对不变(图2)。
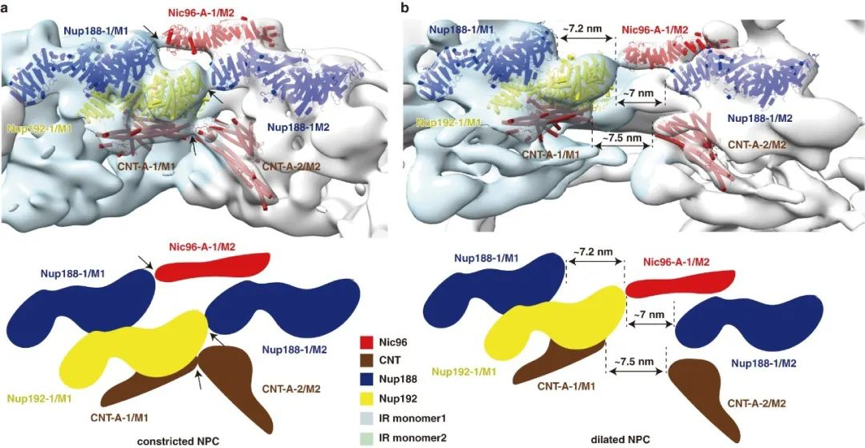
图2. IR的“收缩”和“伸展”机制“收缩”状态(a)和“伸展”状态(b)下邻近内环单体间相互作用的变化
这些研究结果为深入理解NPC的组装、构象变化及其强大的生理功能提供了坚实的结构基础,对理解相关疾病的发病机制以及研发相应的治疗方案和特异性药物也具有重要意义。
清华大学生命科学学院博士生、南方科技大学访问学生李宗强、陈帅嘉彬,清华大学生命科学学院博士后、南方科技大学访问学者赵亮,以及清华大学生命科学学院博士生黄国强为本文共同第一作者,隋森芳院士为本文的通讯作者。清华大学生命科学学院副研究员孙珊、南方科技大学冷冻电镜中心研究教授王培毅也参与了该研究。该研究的主要数据收集和处理工作得到了南科大冷冻电镜中心的大力支持。
论文链接:https://www.nature.com/articles/s41422-022-00632-y
供稿:生命科学学院
文字:李宗强、陈帅嘉彬、赵亮
通讯员:付文卿
主图:丘妍
编辑:朱增光
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
