我校生物系魏志毅副教授成果刊发《核酸研究》 —— 解析人类氨酰tRNA合成酶两种新型剪接异构体结构
日期:2016-02-02
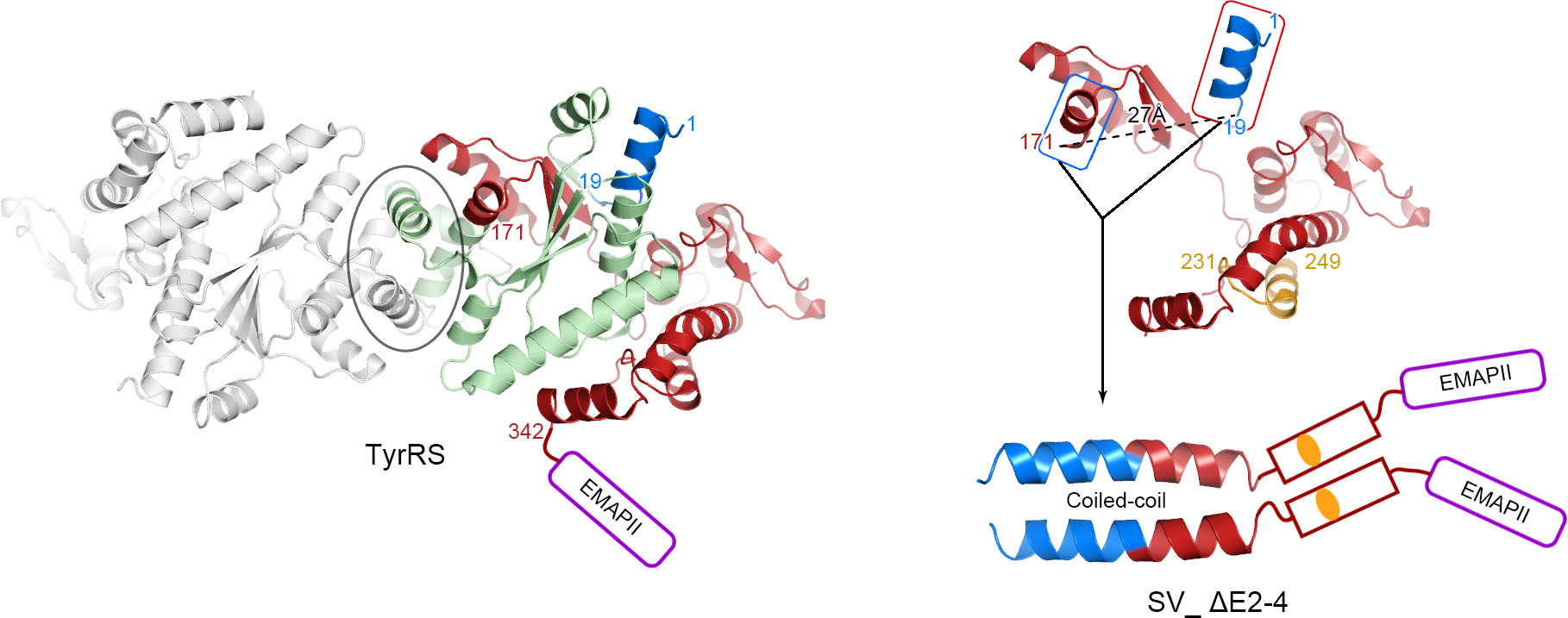
TyrRS剪接异构体形成新型二聚体的结构模型

(左: 魏志毅副教授;中:Paul Schimmel教授;右:许志雯助理教授)
近期,国际著名学术期刊《核酸研究》(Nucleic Acids Research,影响因子9.11)在线发表了由南方科技大学、香港科技大学、美国Scripps研究所和aTyr制药公司联合研究团队的最新研究成果,题为《Alternative splicing creates two new architectures for human tyrosyl-tRNA synthetase》的研究论文。该论文阐述了由可变剪接所形成的两种新型人类tyrosyl-tRNA合成酶剪接体的结构模型。南方科技大学魏志毅副教授和香港科技大学的许志雯助理教授为本文共同第一作者,美国Scripps研究所的美国科学院院士Paul Schimmel教授为本文通讯作者。
作为最古老的酶之一,氨酰tRNA合成酶(AARS)能使氨基酸结合到特定的tRNA上,是保证生物体内蛋白质精确合成的关键酶。近年来,越来越多的AARS在非蛋白质合成方面的功能被人们所发现,包括血管再生、炎症应激反应、mTOR信号通路以及肿瘤发生等。多项研究发现,这些新功能与AARS的剪接异构体(internally deleted splice variants)相关。目前在人类AARS家族中已经发现超过200种新型的剪接异构体,其中大部分已经丧失其催化蛋白质合成功能,同时表现出其他方面的功能。通过分子模拟发现,这些剪接异构体大都发生了较大的结构重组,这与它们所表现出来的非转录功能有着密切的联系,但目前为止对它们的结构信息却知之甚少。
为了能更好地理解AARS剪接异构体的重组结构,包括魏志毅副教授在内的国际联合研究小组分析报道了人类AARS家族成员之一,Tyrosyl-tRNA合成酶 (TyrRS)中的两个新型剪接异构体。这两个剪接异构体分别去除了第2-4个和第2-3个外显子,导致其蛋白产物丧失了原始TyrRS中的催化核心和二聚体相互作用界面部分。但是,随后的生化分析表明,这两个剪接异构体仍能够形成两个具有不同构象的稳定结构。进一步的研究发现,其中一个剪接异构体由于剪接位点而形成了一个全新的Coiled-coil区域,用来形成一个新的二聚体相互作用界面;与此相反,另一个剪接异构体,由于其剪接位点导致的抑制效果,从而趋向形成单体。与大多数TyrRS在各组织细胞中均匀分布不同,这两种新的剪接异构体显示出明显的组织偏好性,其中分别在淋巴细胞中和肺中富集表达,表明它们可能由于聚合状态的差异而具有不同的生物学特性。
该研究结果阐释了人类TyrRS具有复杂的结构可塑性,在不同组织中具有不同的结构重组功能,这为今后研究AARS剪接异构体全新的生物学功能和潜在的疾病医疗效用提供了重要的参考价值。目前,aTyr制药(美国NASDAQ上市公司)正在利用相关研究成果进行转化医学研究,开发新型药物。该项研究获得香港创新科技基金、香港研究资助局、aTyr制药公司、美国国家癌症研究所、美国国家卫生研究院、南方科技大学、深圳科技创新委员会和国家自然科学基金委的经费支持。
文章链接:https://nar.oxfordjournals.org/content/early/2016/01/14/nar.gkw002.full
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
