生物系龚欣副教授在《Nature Communications》发文报道Hedgehog信号通路膜表面受体复合物的最新结构生物学进展
日期:2019-05-24
2019年5月24日,南科大生物系龚欣副教授以通讯作者身份在《Nature Communications》杂志在线发表了题为《Sonic Hedgehog通过非对称范式抑制Patched1四聚体的结构基础》 (Inhibition of tetrameric Patched1 by Sonic Hedgehog through an asymmetric paradigm)的研究成果,报道了Hedgehog信号通路膜表面受体复合物的最新结构生物学进展。
Hedgehog(Hh)信号通路是一条非常经典的细胞信号传导通路,它控制着所有两侧对称动物的胚胎发育及组织再生。胚胎发育时缺乏该信号通路会导致严重的发育异常,但是该信号通路的过度激活会诱发以基底细胞癌和成神经管细胞癌为代表的多种癌症。目前,多家国际制药公司正在积极地开发针对该信号通路的药物来治疗相关癌症。
Hh信号传导通路是由配体蛋白Hh与膜表面受体蛋白Patched (Ptch)的结合而起始的。在缺乏Hh配体的情况下,Ptch受体会通过一种未知的方式间接地抑制下游的Smoothened (Smo)蛋白,从而抑制该信号传导通路;而Hh配体与Ptch受体的结合将会解除Ptch对Smo的抑制,从而激活Smo及其下游的信号传导通路。这条经典的细胞信号传导通路已经被系统地研究了30多年,但是有关Ptch受体的结构和功能研究却相对落后。借助于冷冻电镜技术的快速发展,多个课题组于2018年先后解析了人源或者鼠源Ptch1受体及其与Shh(Hh配体的一种)配体复合物的多个高分辨率冷冻电镜结构(Gong et al, Science, 2018 Jun; Qi et al, Nature, 2018 Jul; Qi et al, Science, 2018 Aug; Zhang et al, Cell, 2018 Nov) (注:龚欣副教授以第一作者身份于2018年6月在Science杂志率先发表了人源Ptch1蛋白单体及其于Shh配体复合物的结构),但是这几篇文章都缺少对Ptch1寡聚化状态的深入研究,也未能提供Ptch1寡聚化的结构基础。
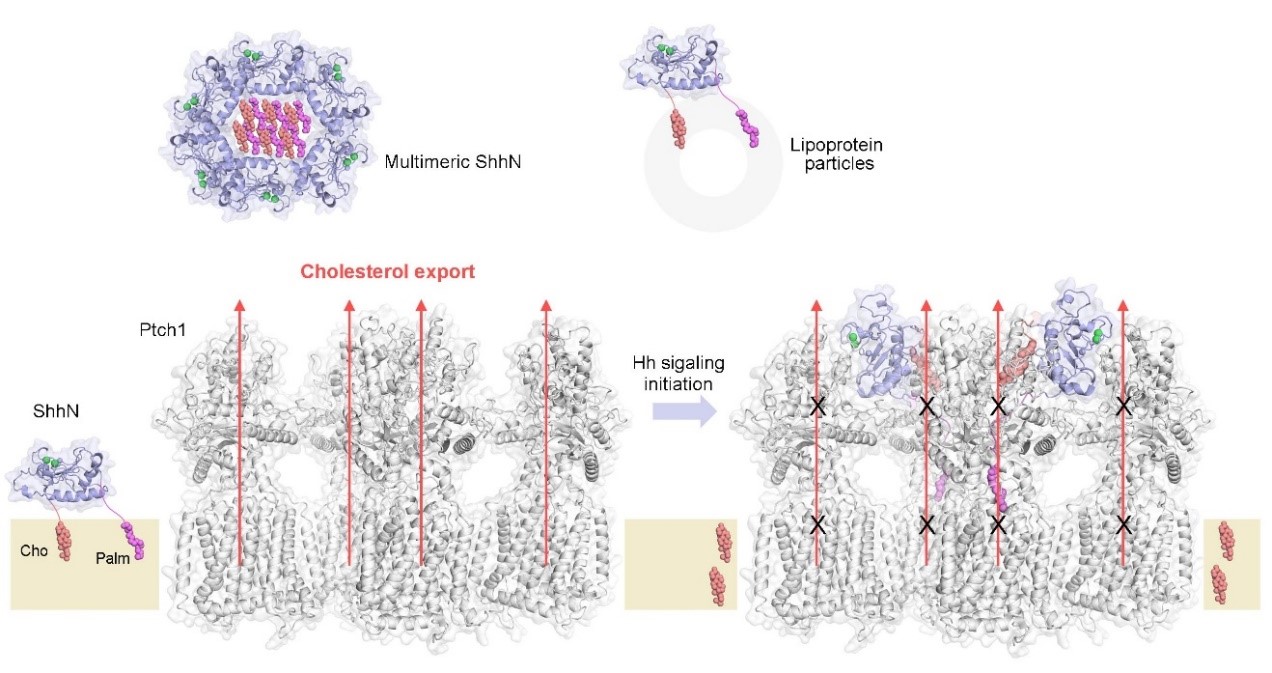
在最新的文章中,作者首先通过生物化学手段证明了在溶液状态下,Ptch1是以四聚体的形式存在。随后解析了Ptch1四聚体与棕榈酰化的Shh配体复合物的冷冻电镜结构,首次揭示了两个蛋白以4:2的形式形成复合物。结构显示一个Shh单体可以同时和两个Ptch1分子结合,并通过非对称范式分别抑制两个Ptch1单体。基于结构观察及不同结构的比对,作者还发现了成熟Shh配体中的胆固醇修饰基团可以插入到Ptch1胞外区的一个固醇结合口袋。
总的来说,该论文揭示的4:2 形式的Ptch1-Shh复合物首次为我们展现了相对完整的Hh信号通路膜表面受体复合物的组装形式,为进一步阐明Hh信号通路的激活机理提供了重要线索。
脂化Shh抑制Ptch1四聚体的模型示意图
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09