生物系余聪、魏志毅、吴传跃和邓怿课题组在《PNAS》发表论文揭示细胞内整合素(integrin)信号通路中的重要蛋白kindlin识别和激活Integrin的结构机理
日期:2017-08-15
近期,我校生物系余聪副教授、魏志毅副教授、吴传跃教授和邓怿副教授课题组围绕细胞内整合素(integrin)信号通路中的重要蛋白kindlin的结构与功能的最新研究成果,在国际著名学术期刊Proceedings of the National Academy of Sciences of the United States of America 在线发表科研论文。 该论文通过解析kindlin 蛋白的三维结构,阐述其识别和激活integrin的结构机制,从分子水平揭示了kindlin在细胞与细胞外基质(ECM)的相互作用以及相关疾病的发生发展过程中如何发挥重要作用。本项研究以南方科技大学生物系为第一单位,所有作者均为我校师生。生物系研究助理李华东(余聪副教授课题组)、邓怿副教授为本文共同第一作者;余聪副教授、魏志毅副教授和吴传跃教授是本文共同通讯作者。今年毕业的2013级本科生林继镕作为共同作者参与了该项工作。
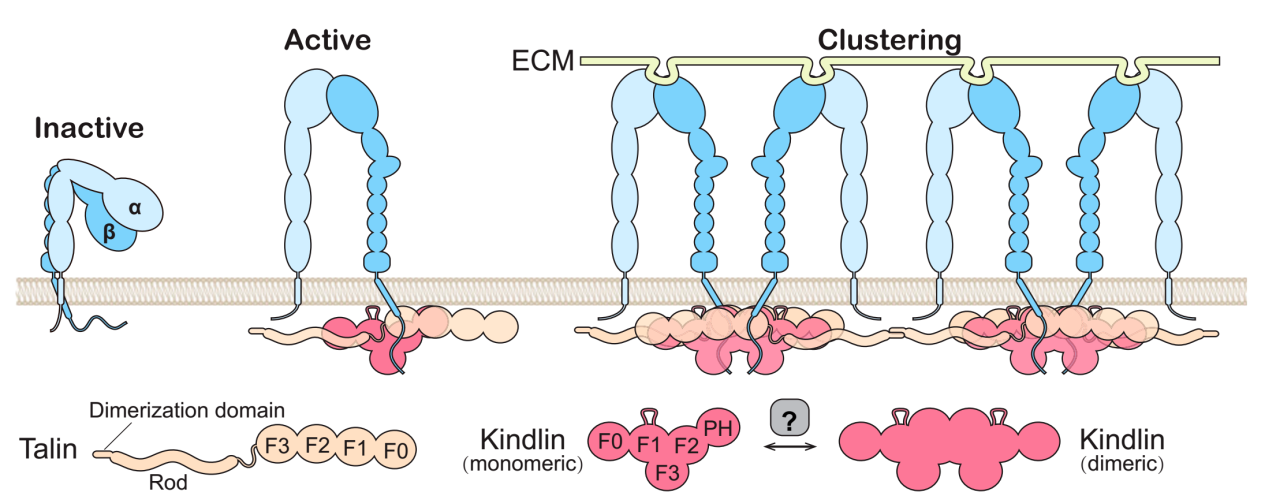
细胞与其微环境的相互作用对细胞迁移、增殖等多种生命活动过程的调控具有重要作用,细胞粘附的缺陷会导致发育、免疫和止血功能失常等多种疾病。整合素(integrin)是细胞- ECM 粘附中最重要的受体,通过自身的细胞外结构域和细胞内tails端,连接着细胞外基质的特异蛋白和细胞内不同的细胞骨架调控蛋白。Integrin和细胞外基质稳定的相互作用及随后的信号传导都需要Integrin处于活化状态。作为integrin的结合蛋白,Kindlin和talin是两个序列相似的、含FERM结构域的蛋白家族,两者协同作用进而完全激活integrin。Talin结合integrin细胞内β-tail的近膜端,从而改变integrin的构象,但kindlin识别integrin并介导其完全活化的分子机制并不清楚,而且kindlin的突变也常导致皮肤性、免疫性疾病、造血功能失常、骨骼疾病,以及癌症。
本项研究通过X-ray解析了kindlin家族中分布最广,最重要的分子kindlin2的单体和二聚体两种构象及kindlin结合β1- and β3-integrin的复合物结构,揭示了Kindlin2的结构跟Talin-FERM的线性结构截然不同,呈现紧密堆积的三叶草形态;复合物结构进一步表明kindlin是通过两个特异的结合位点识别integrin细胞内β-tail的远膜端,这对激活integrin及其信号传导有重要作用。值得关注的是,本项研究意外地发现kindlin2存在着构象变化,kindlin单体可以通过F2 domain-swapping形成同源二聚体,打破二聚体的形成会影响到kindlin介导的integrin的完全活化。
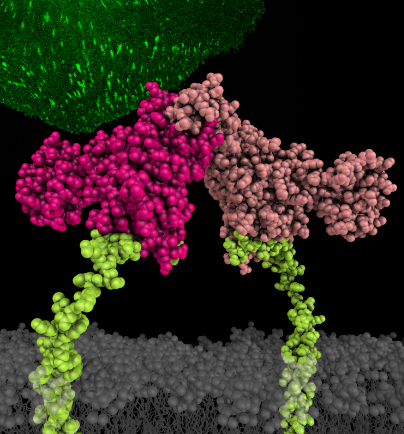
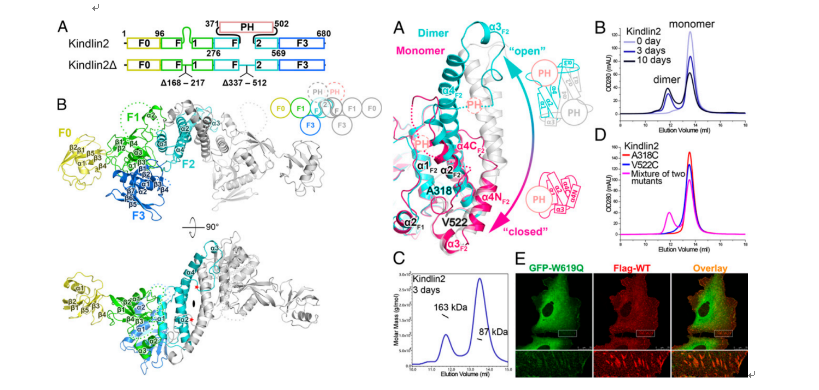
该项研究成果综合运用了结构生物学、生物化学及细胞生物学的方法,解决了相关领域长期存在的一个重要问题,系统地揭示了kindlin与integrin相互作用的结构基础,提出了kindlin在integrin活化过程中发挥作用的新的机理。同时,蛋白三维结构信息也帮助人们理解kindlin的突变在众多遗传疾病的机理,为今后相关疾病及癌症的治疗提供基础。该项研究标志着南科大在本研究领域处于国际前沿,获得相关领域研究者的高度重视。本文的editor,美国科学院院士、integrin研究领域的专家Richard Hynes特别邀请德国马普研究所Reinhard Fässler教授为本文撰写专题评论。实验室将继续在此基础上,进一步研究相关领域的重要问题,欢迎感兴趣的研究人员或者学生加入。
这项研究得到了南方科技大学生命科学研究中心、上海国家蛋白质科学中心、上海同步辐射光源中心的支持,并获得国家自然科学基金委员会,国家科技攻关计划,广东省自然科学基金、深圳科技创新委员会及南方科技大学的经费支持。
相关链接:http://www.pnas.org/content/early/2017/07/20/1703064114.long
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
