南科大郭红卫课题组揭示植物幼苗出土见光转绿过程的调控新机制
日期:2025-05-30
近日,南方科技大学生命科学学院生物系讲席教授郭红卫课题组在国际权威期刊PNAS上在线发表了题为Arabidopsis HOOKLESS1 acts as a histone acetyltransferase to promote cotyledon greening during seedling de-etiolation的研究论文。该研究通过分子遗传学、分子生物学和生物化学等方法详细阐明了拟南芥HLS1促进黄化幼苗见光转绿过程的分子机制。
在通过暗形态建成突破土壤覆盖后,黄化幼苗将在光信号的诱导下完成转绿 (greening) ,进而进入光合自养阶段。在模式植物拟南芥中,叶绿素积累和叶绿体成熟是黄化幼苗顺利转绿的显著标志。这一过程中,黄化幼苗中积累的原叶绿素酸酯 (Pchlide) 在光照下由光依赖型的NADPH:原叶绿素酸酯氧化还原酶 (LPORs) 催化,还原为叶绿素酸酯 (Chlide ,chlorophyll a的直接前体),是叶绿素合成的关键步骤。若Pchlide积累量和LPORs催化能力之间的平衡被打破,将会引发光氧化损伤导致黄化幼苗见光转绿失败。对水稻和高粱等作物而言,转绿效率直接影响其出苗率和光能利用率,具有重要农业价值。因此,解析黄化幼苗出土见光转绿的调控机制,不仅将深化我们对植物在快速光暗环境变化下适应性的认知,还能为培育高转绿效率的作物提供理论基础。
黄化幼苗的见光转绿过程受到多种内、外源因素的共同调控。研究表明,乙烯信号依赖于其下游核心转录因子EIN3 (ETHYLENE INSENSITIVE 3) / EIL1 (EIN3-LIKE 1) 显著地促进黄化幼苗见光转绿过程。因此,深入研究EIN3/EIL1介导的转录调控机制,将有助于阐明复杂信号网络协同调控黄化幼苗见光转绿过程的具体分子机制。此外,尽管已有研究表明组蛋白乙酰转移酶参与光响应基因的表达调控,但建立黄化幼苗转绿过程中组蛋白乙酰化修饰的关键酶仍不清楚。
在本研究中,该课题组成员首先发现,经典的暗形态建成调控因子,HOOKLESS1(HLS1),依赖于其乙酰转移酶活性促进拟南芥黄化幼苗的见光转绿过程。转录组测序分析(mRNA-seq)表明,HLS1显著促进黄化幼苗中转绿相关基因的转录激活。分子生化实验表明HLS1在体外可直接乙酰化组蛋白H3,并在体内负责转绿相关基因附近组蛋白乙酰化修饰。此外,HLS1介导的组蛋白乙酰化修饰有利于乙烯信号转录因子EIN3结合靶基因,进而确保转绿相关基因的表达。因此,HLS1介导的组蛋白乙酰化修饰很可能是黄化幼苗整合内外源刺激并确保见光转绿过程的关键机制。
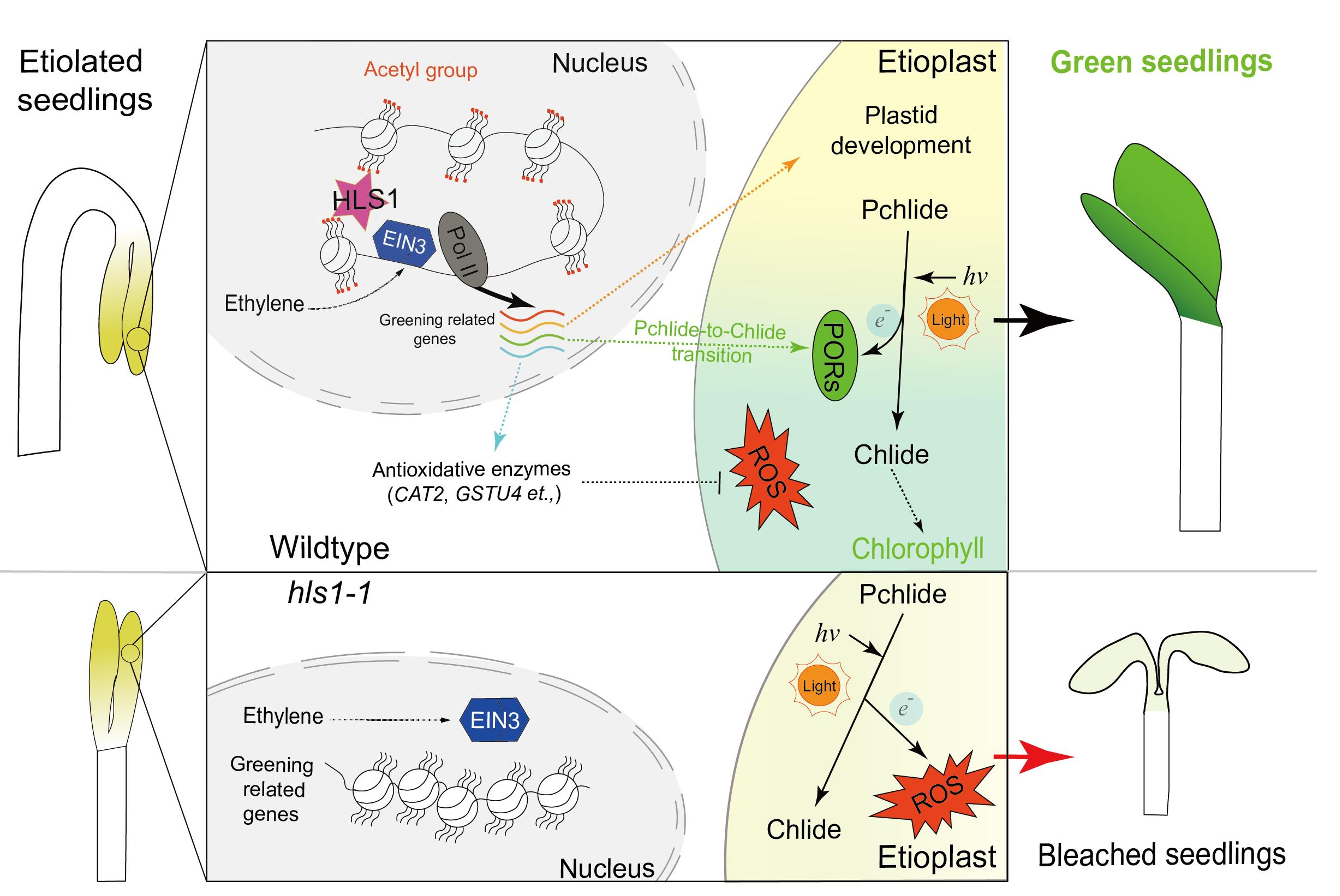
图1:工作模型:HLS1介导的组蛋白乙酰化调控黄化苗光转绿过程
图1中上方卡通图片示意在野生型黄化幼苗(上)和hls1-1突变体黄化幼苗(下)见光转绿过程的模式图。在野生型中,HLS1蛋白可以促进转绿相关基因附近组蛋白乙酰化水平的升高,有助于乙烯信号核心转录因子EIN3/EIL1结合到这些基因的启动子区域,从而促进转绿相关基因的表达,最终确保黄化幼苗顺利完成见光转绿过程。
郭红卫课题组长期致力于气体激素乙烯在调控植物黄化幼苗破土和见光转绿过程中相关机制的研究。近年来郭红卫课题组还率先报道了HLS1蛋白的乙酰化酶活性(Huang et al., 2023 Plant Cell;Guo et al., 2023 Plant J.)。结合之前的研究成果,郭红卫课题组系统性地描绘了植物幼苗出土见光转绿过程的调控机制。
南方科技大学生命科学学院生物系郭红卫教授课题组博士后彭旸和彭滔为该论文的共同第一作者,郭红卫和高级工程师王益川为论文共同通讯作者,南科大为论文唯一通讯单位。郭红卫课题组博士研究生初奕杉、研究助理教授严维、本科生姚润祎、工程师温兴、博士后裘喻平、博士研究生王孟、硕士研究生陈小倩、研究助理肖志娜、张丹、尹竹君也参与了本研究工作。该研究中所使用ChIP-seq实验技术得到了南方科技大学生命科学学院生物系吴柘副教授的大力支持。该研究得到了国家自然科学基金重点项目、新基石实验室基金、广东省植物细胞工厂分子设计重点实验室基金、深圳市科创委的资助。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2425647122
文字:彭旸、郭红卫
通讯员:邹冬霞、罗舒文
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
