1个月内连发2篇顶刊!生科院近期科研成果速览
日期:2025-05-15
2025年4月以来
生科院科研团队
1个月内连发2篇顶刊
另有多篇成果发表在高水平期刊上
创新硕果频出
让我们一起来看看
生科院四月以来丰硕的科研成果吧!
生科院近期科研成果速览
01 Cell | 郭红卫团队联合武汉华大研究院解析单细胞水平叶片衰老和源库转运
02 Cell | 黄安诚团队联合破解调控水稻分蘖的“菌源密码”
03 Autophagy | 赵燕团队揭示ATG2A调控神经细胞中自噬体成熟的机制
04 Nature Communications | 刘忠民团队联合揭示丝氨酸/苏氨酸蛋白磷酸酶PPEF家族的激活机制
05 PNAS | 侯圣陶课题组发现阻断CD47调控小胶质细胞吞噬突触治疗自闭症动物模型新机制
06 Nature Communications | 闫凯歌团队揭示PhK蛋白活性调控和底物结合机制
07 Nucleic Acids Research | 王泽峰团队开发深度学习模型Translation AI,助力揭示RNA翻译调控新机制
科研成果
01 郭红卫团队联合武汉华大研究院解析单细胞水平叶片衰老和源库转运
生命科学学院生物系讲席教授郭红卫课题组联合武汉华大生命科学研究院在顶级学术期刊Cell在线发表题为“An Arabidopsis single-nucleus atlas decodes leaf senescence and nutrient allocation”的研究论文,构建了模式生物拟南芥全生命周期单细胞转录组图谱,并创新性地从单细胞水平上解析了叶片衰老进程,描绘了碳/氮的源库转运图景。
研究团队利用单核测序技术构建了覆盖拟南芥全生命周期的表达图谱,为植物功能研究提供了重要的转录组资源,同时创新性地将植物衰老研究提升到单细胞水平,为解析关键衰老调控网络和精准调控植物性状提供了重要的理论支持,也为单细胞测序在植物科学领域的研究提供了新的研究范式和应用前景。
郭红卫教授,华大生命科学研究院研究员徐讯、刘欢为论文共同通讯作者。郭红卫课题组高级工程师王益川博士、研究助理教授严维博士,武汉华大生命科学研究院郭兴博士、赵彩耀博士、谈聪博士为论文共同第一作者。
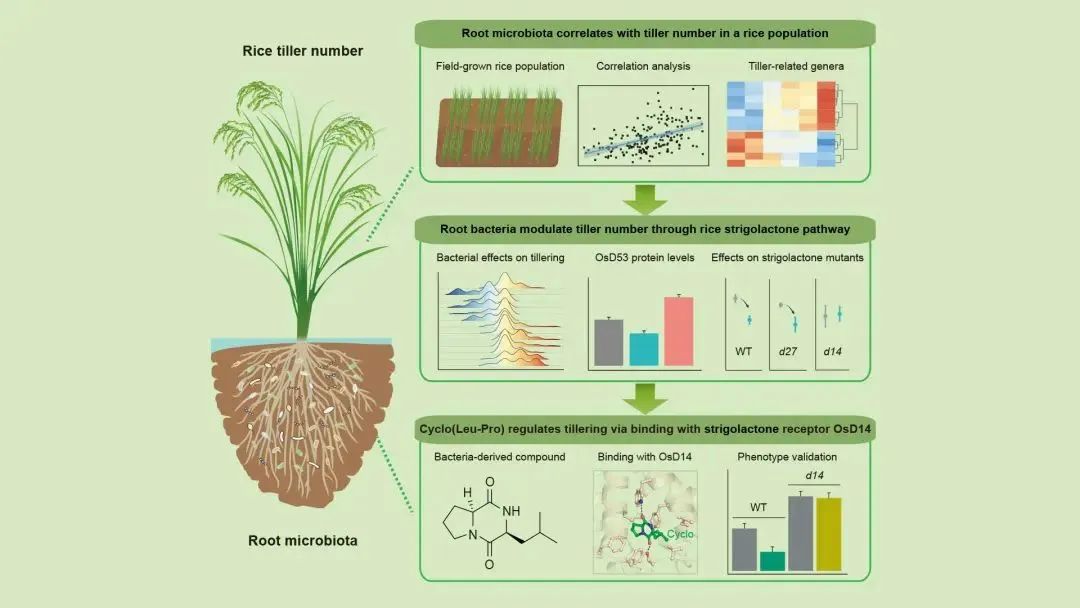
02 黄安诚团队联合破解调控水稻分蘖的“菌源密码”
生命科学学院生物系黄安诚副教授联合北京大学白洋研究员、崖州湾国家实验室/中国科学院遗传与发育生物学研究所李家洋研究员、华南农业大学储成才教授、中山大学高嵩研究员带领的五个顶尖科研团队联合攻关,在顶级期刊《细胞》(Cell)发表题为“Root microbiota regulates tiller number in rice”的研究成果。
该研究通过整合微生物组学、分子生物学、作物遗传学、天然产物化学及结构生物学等技术,首次系统揭示了根际微生物组调控水稻分蘖的功能与分子机制,成为植物-根际微生物互作研究的教科书级范例。研究利用丰富的菌种资源挖掘调控水稻分蘖的重要菌株,形成“数据挖掘-功能机制解析”的完整闭环,标志着植物微生物组研究从描述性科学迈向功能机制解析与工程化应用的新纪元,为作物增产与粮食安全提供了突破性科技支撑。
南方科技大学博士研究生于经纬、中国科学院遗传与发育生物学研究所/北京大学副研究员张婧赢、中国科学院遗传与发育生物学研究所研究员王冰、徐浩然、博士研究生刘伟东,中山大学王秋霞、崖州湾国家实验室研究员余泓、中国科学院遗传与发育生物学研究所魏金伟为本文的共同第一作者。白洋、李家洋、储成才、黄安诚、高嵩为共同通讯作者。
南方科技大学植物生物学方向自2017年引进教育部特聘教授、国家杰出青年基金获得者、新基石研究员郭红卫教授为学科带头人,组建植物与食品研究所,该方向进入快速发展阶段,形成了涵盖植物分子生物学、激素信号转导、表观遗传组学、合成生物学等多领域的高水平研究团队。先后建成广东省植物细胞工厂分子设计重点实验室、深圳市植物基因工程与分子设计重点实验室等特色科研平台,为学科发展提供坚实支撑。研究团队聚焦国际植物科学前沿,围绕植物环境感知机制、次生代谢通路、表观遗传学调控等关键科学问题,开展系统性、原创性研究。近年来,该方向持续产出颠覆性科研成果。团队成员以通讯作者在《自然》、《科学》、《细胞》等国际顶级学术期刊发表论文7篇,多项研究成果被国际权威学术机构高度评价与广泛引用。
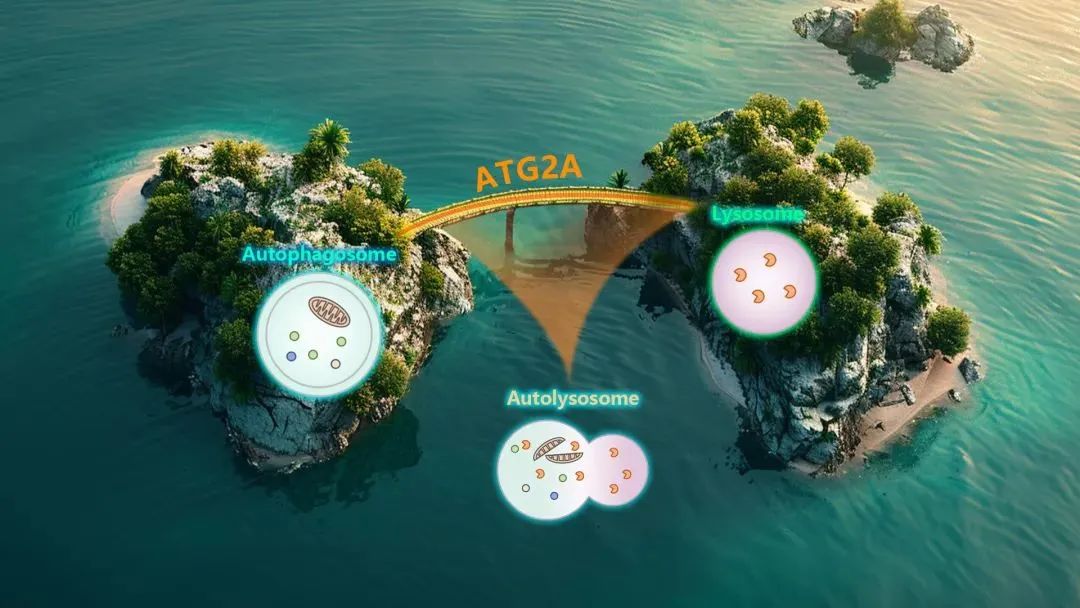
03 赵燕团队揭示ATG2A调控神经细胞中自噬体成熟的机制
生命科学学院神经生物学系副教授赵燕课题组在国际学术期刊Autophagy上发表了题为“ATG2A acts as a tether to regulate autophagosome-lysosome fusion in neural cells”的研究论文,揭示了ATG2A在神经细胞中通过结合SNARE膜融合复合物等分子,调控自噬小体和溶酶体的融合过程。
该研究揭示了 ATG2A 在神经细胞自噬体成熟中的关键作用,ATG2A,而非 ATG2B,作为栓系蛋白介导了自噬小体与晚期内吞体/溶酶体的融合。这项研究不但有助于理解神经细胞自噬小体成熟的分子机制,对于预防或治疗相关自噬缺陷引起的神经退行性疾病也具有重要意义。南方科技大学博士研究生郑泽为论文第一作者,赵燕为本论文通讯作者。
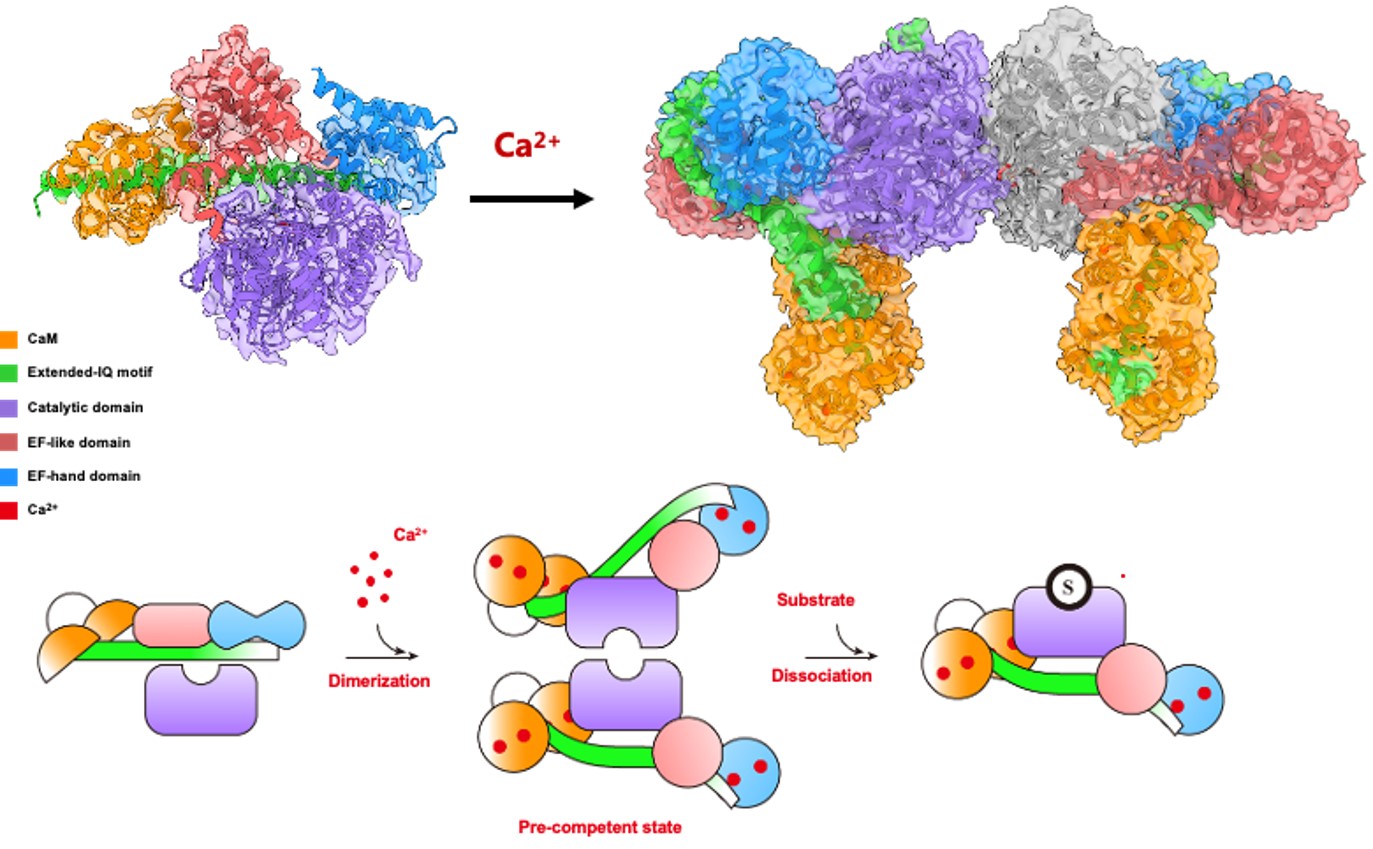
04 刘忠民团队联合揭示丝氨酸/苏氨酸蛋白磷酸酶PPEF家族的激活机制
生命科学学院基础免疫与微生物学系刘忠民助理教授团队与北京大学医学部刘伟研究员团队、华南理工大学李健潮教授团队合作在国际权威期刊《自然·通讯》(Nature Communications)发表题为“Structural insights into the dual Ca2+-sensor-mediated activation of the PPEF phosphatase family”的重要研究成果。该研究首次揭示了丝氨酸/苏氨酸蛋白磷酸酶PPEF家族的双重钙离子传感激活机制,为乳腺癌、胃癌等重大疾病的靶向治疗提供了新的理论依据和潜在干预策略。
本研究首次揭示了PPEF家族磷酸酶通过双重钙传感器协同作用驱动延伸IQ基序“杠杆式”翻转的激活机制,为理解丝氨酸/苏氨酸蛋白磷酸酶的动态调控提供了新视角。同时,通过结构-功能解析锁定关键调控位点,为靶向PPEF介导的疾病(如乳腺癌、胃癌及遗传性神经退行性疾病)提供了潜在的精准干预策略。此外,该研究还为其他钙依赖性磷酸酶的调控机制提供了借鉴,为新型药物开发和信号通路研究奠定了基础。该论文由刘忠民、刘伟和李健潮共同担任通讯作者。医学中心博士研究生刘佳与南方科技大学博士研究生吴藏为共同第一作者。
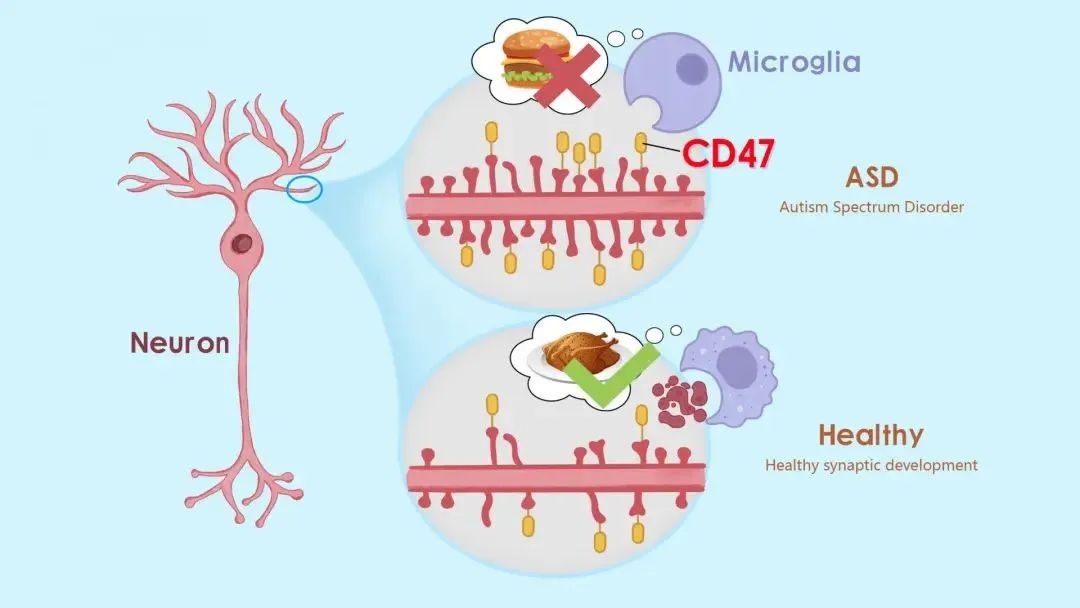
05 侯圣陶课题组发现阻断CD47调控小胶质细胞吞噬突触治疗自闭症动物模型新机制
生命科学学院教授侯圣陶课题组在《美国科学院院刊》(PNAS)在线发表了题为“The don't eat me signal CD47 is associated with microglial phagocytosis defects and autism-like behaviors in 16p11.2 deletion mice”的研究论文。该研究报道,一种调节免疫反应的关键蛋白CD47,通过增强大脑小胶质细胞的突触吞噬作用,下调兴奋性突触传递,有效改善了自闭症小鼠模型中的社交趋新障碍。
这项研究确定了CD47水平在自闭症中的异常升高,而阻断其信号通路,可以增加小胶质细胞吞噬,下调兴奋性突触传递,进而缓解自闭症小鼠的社交趋新缺陷。阻断CD47有望进一步发展为一种临床上可行的自闭症治疗方法。侯圣陶团队研究助理教授鞠俊为论文第一作者,侯圣陶为论文唯一通讯作者,南科大为论文唯一通讯单位。
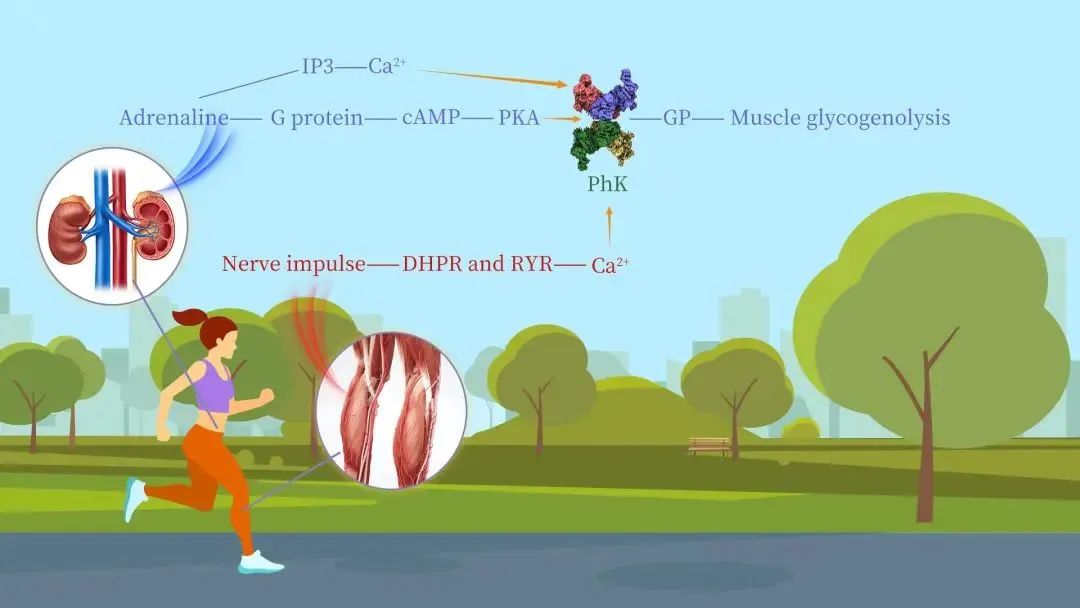
06 闫凯歌团队揭示PhK蛋白活性调控和底物结合机制
生命科学学院化学生物学系助理教授闫凯歌团队在Nature Communications期刊发表了题为“Molecular basis for the regulation of human phosphorylase kinase by phosphorylation and Ca2+”的研究成果。研究团队利用近原子分辨率的冷冻电镜技术,解析了蛋白激酶PhK无活性和激活状态下的结构,结合生化实验揭示了其活性调控和底物结合的机制。
在本研究中,闫凯歌团队成功解析了PhK在无活性状态和磷酸化/Ca2+激活状态下的高分辨率冷冻电镜结构,通过这些结构研究,团队揭示了PhK复合物中四个亚基(αβγδ)的相互作用和相对位置。南方科技大学为第一通讯单位。南科大研究助理教授马瑞芳、博士生杜博文和浙江大学博士生时晨为论文共同第一作者。闫凯歌助理教授和浙江大学王勇教授为论文共同通讯作者。
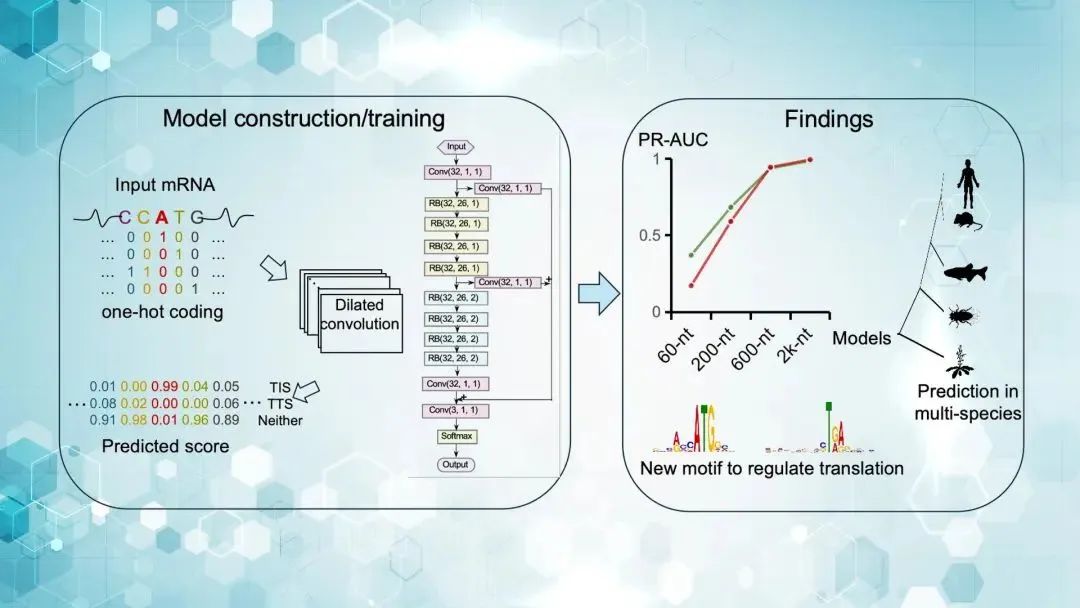
07 王泽峰团队开发深度学习模型Translation AI,助力揭示RNA翻译调控新机制
生命科学学院系统生物学系王泽峰讲席教授团队成功开发 Translation AI模型,在国际期刊Nucleic Acids Research发表题为“Analysis of RNA translation with a deep learning architecture provides new insight into translation control”的研究论文。该研究构建了一种基于深度神经网络的模型,可准确预测RNA分子的翻译起始位点(Translation Initiation Sites, TIS)和终止位点(Translation Termination Sites, TTS),并揭示了密码子使用偏好在翻译终止过程中的潜在调控作用,为理解转录后调控机制提供了新工具和新思路。
研究团队设计并训练了 Translation AI 模型。该模型基于多层级扩张卷积神经网络架构,使用全长 mRNA 序列作为输入,在不依赖已知特征或人工注释的前提下,从序列中学习出翻译调控的隐藏规则。目前,Translation AI 已上线为网页工具,供科研人员上传 RNA 序列并预测其翻译起始与终止位点(网址:https://www.biosino.org/TranslationAI/),以便研究人员分析各类转录本的翻译潜力。王泽峰和原中国科学院上海营养与健康研究所、现美国国立卫生研究院关节肌肉骨骼及皮肤病研究所樊晓娟博士为论文共同通讯作者,樊晓娟、美国国立卫生研究院癌症研究所常天根和中国科学院上海营养与健康研究所博士研究生陈楚赟为论文共同第一作者。
最新动态
-
南科大郭红卫课题组揭示植物幼苗出土见光转绿过程的调控新机制
Date:2025-05-30
-
生命科学学院举办“人际共生菌落培养”心理实验日活动 —— 用科学浪漫解码人际关系密码
Date:2025-05-29
-
南科大黄安诚团队创制高产异黄酮植物底盘实现大豆素等异黄酮植保素的绿色生物全合成
Date:2025-05-29
-
生命科学学院持续开展“访企拓岗促就业”活动
Date:2025-05-26