南科大刘忠民团队联合天津医科大学张恒团队合作揭示Cas9d靶标识别和切割机制
日期:2025-03-17
近日,南方科技大学生命科学学院基础免疫与微生物学系刘忠民团队与天津医科大学的张恒团队在Nature Communications期刊发表了题为Insights into the compact CRISPR-Cas9d system的研究成果。研究团队利用近原子分辨率的冷冻电镜技术,解析了Cas9d-sgRNA复合体在无靶标状态及靶标结合状态下的结构,结合生化实验揭示了其PAM识别与DNA切割机制。

CRISPR-Cas系统是原核生物中广泛存在的RNA引导的适应性免疫系统。其中 2类II型CRISPR-Cas系统是由单个效应蛋白Cas9核酸酶、CRISPR RNA(crRNA)及反式激活crRNA(tracrRNA)共同构成的双RNA引导防御系统。2类II型CRISPR-Cas9系统根据CRISPR基因座结构差异可进一步分为II-A、II-B、II-C和II-D四个亚型。最新研究发现的II-D型Cas9同源蛋白-来源于Deltaproteobacteria细菌的MG34-1 Cas9(也称Cas9d)由747个氨基酸构成,大小仅相当于广泛应用的基因编辑工具Streptococcus pyogenes (Spy)Cas9的一半。Cas9d与单链向导RNA(sgRNA,用linker连接的crRNA与tracrRNA)的总长不足3.4 kb,因此适配于腺相关病毒的递送。然而,尽管Cas9d展现出基因组编辑潜力,其维持核酸酶活性的分子机制仍待阐明。
研究团队首先分别解析了分辨率为2.8 Å的Cas9d-sgRNA核糖核蛋白复合物结构和2.68 Å的Cas9d-sgRNA-target DNA三元复合物结构。Cas9d包含桥状螺旋结构域(BH)、目标识别结构域(REC)、楔形结构域(WED)、PAM互作结构域(PI)和两个核酸酶结构域:RuvC结构域(I、II、III)和HNH结构域。Cas9d能够识别并切割具有NGG PAM位点的双链DNA靶标。通过冷冻电镜结构解析与生化分析,研究团队揭示了PAM识别机制:在靶标结合状态下,PAM区域同时由WED结构域与PI结构域共同锚定,这一特征使其区别于仅依赖PI结构域识别NGG PAM的SpyCas9及Francisella novicida (Fno)Cas9。
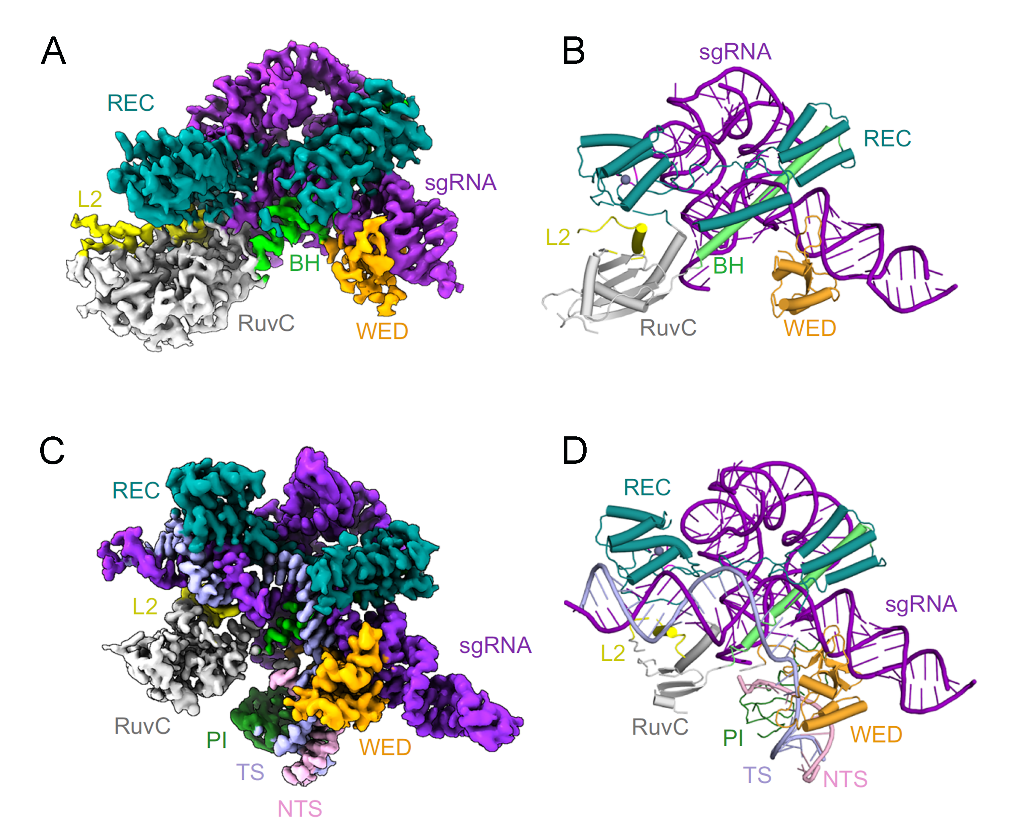
图1 Cas9d-sgRNA和Cas9d-sgRNA-target复合物的整体结构
通过结构比对,研究团队进一步发现sgRNA中的一段与REC结构域相互作用,形成功能性靶标识别模块(REM),REM对Cas9d的稳定和核酸酶活性十分重要。此外,研究团队还发现在靶标结合后,REM会实现的构象重排,从而促进核酸酶活性;而核酸酶活性则需要向导-靶标(Guide-target)异源双链体中至少17个碱基。总之,sgRNA除了作为Cas9酶和靶标之间的适配器的典型作用外,还为Cas9d提供结构支持和功能调控,使得核酸酶酶活性维持良好,错配容忍度更低。
该研究不仅揭示了Cas9d独特的靶标识别和切割机制,还为高保真微型CRISPR工具的开发提供了启示。
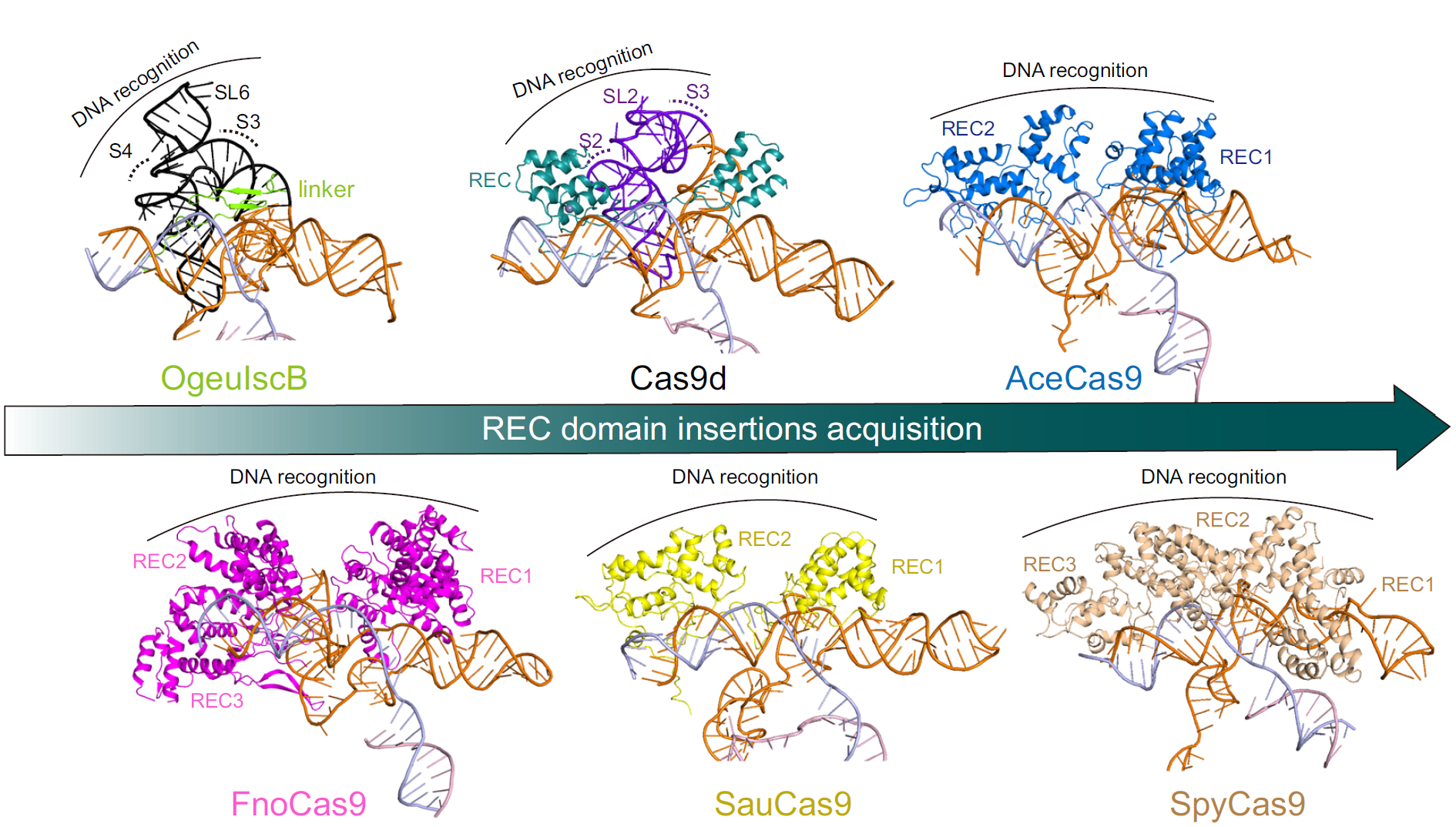
图2 Cas9同源蛋白与Cas9祖先蛋白IscB的结构比较
张恒教授、刘忠民助理教授为该论文的共同通讯作者。天津医科大学的杨洁、王童瑶研究生、南科大已毕业博士生黄颖、天津医科大学的龙兆钇研究生为该论文的共同第一作者。冷冻电镜数据收集和处理得到了南科大高分辨生物电镜结构研究院和南科大冷冻电镜中心的大力支持。该工作得到了国家自然科学基金、广东省科学技术厅(基础与应用基础研究团队项目)、广东省自然科学基金、深圳市科创委和南方科技大学的资助。
原文链接:https://www.nature.com/articles/s41467-025-57455-9
供稿:生命科学学院刘忠民课题组
文字:黄颖
编辑:付文卿
审核:万峻
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
