南科大刘忠民课题组合作揭示ADAR蛋白通过构象重排介导的RNA编辑新机制
日期:2025-03-05
近日,南方科技大学生命科学学院刘忠民课题组联合清华大学欧光朔课题组在国际著名学术期刊Nucleic Acids Research上发表了题为“Conformational Reorganization and Phase Separation Drive Hyper-Editing of ADR-2-ADBP-1 Complex”的研究论文,揭示了ADAR蛋白通过构象重排介导的RNA编辑新机制。
腺苷脱氨酶(ADAR,adenosine deaminase acting on RNA)在RNA编辑中发挥关键作用,通过将双链RNA中的腺苷(A)转化为肌苷(I),从而调控基因表达和RNA功能,影响多种生物学过程和疾病的发生。作为先天性免疫系统的重要组成部分,ADAR在进化过程中通过保护组织免受逆转录病毒感染,并在组织受损时引导修复和再生。值得注意的是,A到I的编辑不仅局限于具有位点选择性的mRNA编码区中少数的编辑位点,还广泛发生于灵长类动物中丰富的Alu和LINE逆转录元件中。在这些元件中,多个相邻的腺苷位点以随机方式被过度编辑,这种现象也被称为超编辑。ADAR介导的超编辑现象并不局限于人类,在线虫、小鼠、爪蟾、章鱼和果蝇等不同物种中也被广泛观察到,然而,ADAR家族是如何实现如此高效的超编辑过程的具体机制仍不清楚。
在线虫中,ADR-2是唯一具有编辑活性的ADAR蛋白,其活性受到结合蛋白ADBP-1的调控。最近的研究发现,ADR-2的超编辑作用通过损害纤毛激酶dyf-5的pre-mRNA剪接,导致纤毛功能异常。这一发现揭示了ADR-2介导的超RNA编辑可能在细胞功能失调和疾病发生中的潜在作用。因此,线虫中的ADR-2为研究超编辑提供了一个理想的模型系统。
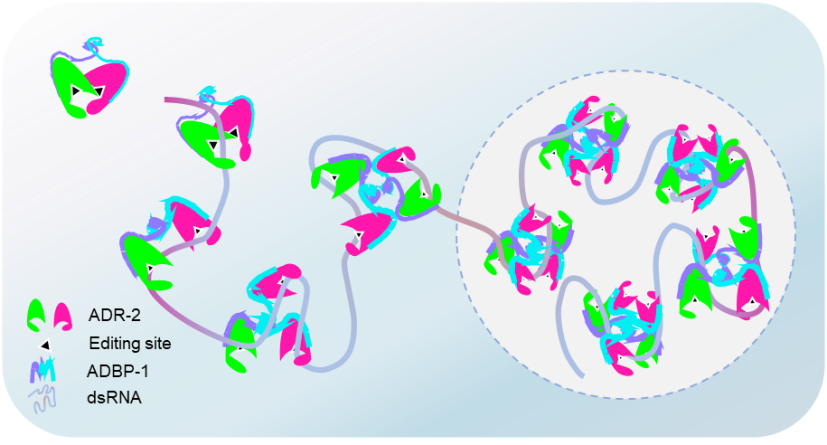
刘忠民团队首先通过冷冻电子显微镜(cryo-EM)解析了秀丽隐杆线虫的ADAR蛋白ADR-2与其结合蛋白ADBP-1组成的异源四聚体的高分辨三维结构。ADR-2与ADBP-1形成了一个稳定、紧凑的复合物,化学计量比为2:2。在这种构象中,一个编辑位点处于开放状态,而另一个则被阻断。然而,当获得ADR-2-ADBP-1复合物与底物RNA结合的结构时,研究发现,随着RNA的加入,ADR-2二聚体趋向解离,形成更加松散的二聚体,此时ADR-2二聚体的两个编辑位点均开放,这可能代表了一种更高效的编辑模式。
进一步的冷冻电镜结果显示,ADR-2-ADBP-1在RNA加入后,除了形成二聚体外,还会形成三聚体、四聚体和多聚体。研究人员对这种寡聚化状态是否可能代表一种生理状态进行了深入探讨。考虑到液-液相分离(LLPS)在许多蛋白质聚集过程中发挥的重要作用,研究人员推测,ADR-2-ADBP-1复合物的多聚体状态可能与LLPS相关。在线虫体内的荧光定位实验中,研究人员观察到ADR-2和ADBP-1呈现点状定位,这一现象进一步支持了其在细胞中可能通过LLPS形成多聚体的假设。通过一系列体内外实验,研究者证实ADR-2-ADBP-1复合体具备相分离的特性,并能够发生相分离现象。
那么,ADR-2-ADBP-1的相分离具有什么样的生物学功能呢?编辑实验发现,利用PEG8000模拟的ADR-2-ADBP-1复合体相分离中,底物的超编辑事件显著高于未发生相变的情况。因此,研究者认为,ADR-2-ADBP-1通过相分离形成的液滴状结构可能在RNA编辑过程中发挥调控作用,促进底物RNA的编辑。此外,相分离还可能有助于在特定细胞区域集中和调控RNA编辑相关分子,从而确保RNA编辑活动的高效性和时空特异性。
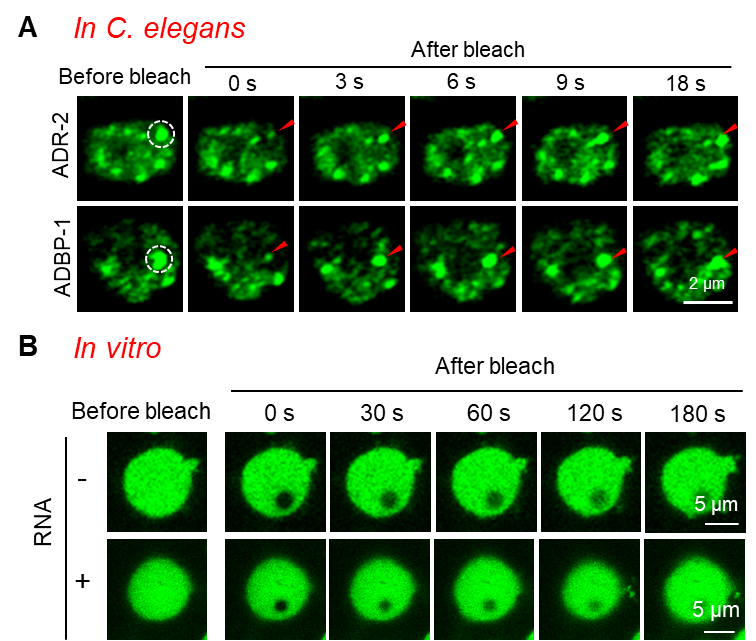
图1:ADR-2的液滴荧光漂白恢复影像图
综上所述,刘忠民团队研究了ADR-2及ADR-2–ADBP-1复合物的结构重排如何调控ADR-2的编辑模式。从ADR-2二聚体中催化位点被阻断导致的编辑模式,到通过LLPS介导的ADR-2颗粒中多个有效催化位点促进的超编辑,这一过程揭示了ADAR蛋白通过构象重排调控RNA编辑的全新机制。该研究不仅为ADAR介导的RNA超编辑提供了结构性解释,还为开发更高效的RNA编辑工具提供了重要的理论支持。
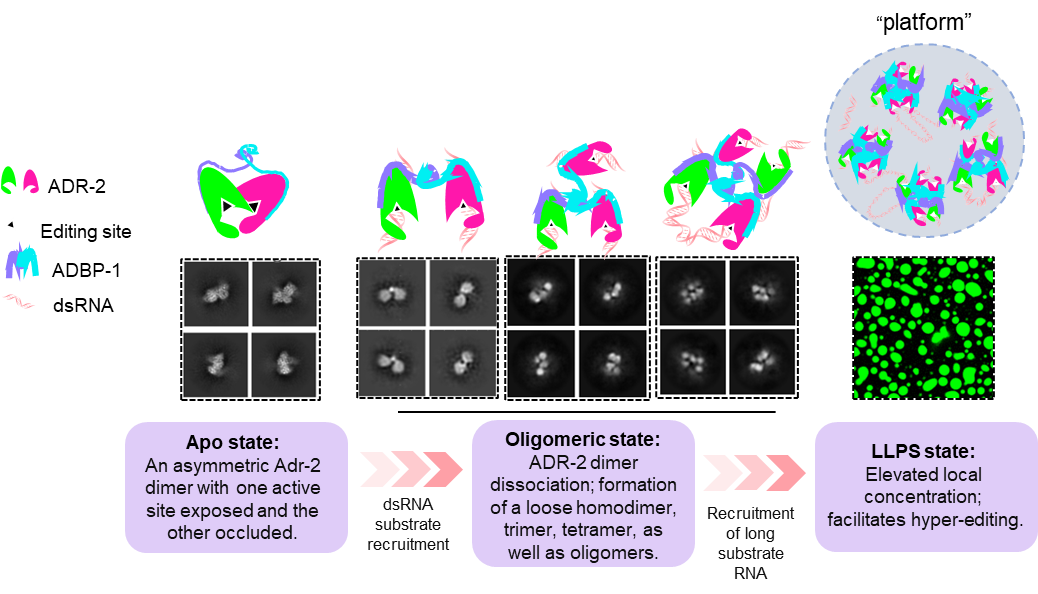
图2:ADR-2介导的RNA编辑机制示意图
南方科技大学为第一通讯单位。南方科技大学博士研究生穆建强和吴藏为论文共同第一作者。南方科技大学刘忠民助理教授和清华大学欧光朔教授为论文共同通讯作者,南方科技大学博士后付亚娟、硕士研究生刘心港、科研助理张振、博士生于经纬、博士生薛晨阳、研究助理教授陈昕朦、科研助理陈艳红参与了该工作。清华大学博士生许凯铭、博士后王梓、博士生陈哲在线虫体内实验中提供了重要帮助。苏州大学李冬冬副教授对本课题提供了建议和帮助。冷冻电镜数据收集和处理得到了南科大冷冻电镜中心和南科大高分辨生物电镜结构研究院,以及会对水木未来的大力支持。该工作得到了国家自然科学基金、广东省科学技术厅(基础与应用基础研究团队项目)、广东省自然科学基金、深圳市科创委和南方科技大学的资助。
原文链接:https://doi.org/10.1093/nar/gkaf148
供稿:生命科学学院刘忠民课题组
文字:穆建强
编辑:付文卿
审核:万峻
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
