南科大饶枫课题组在Nature Communications发文揭示发育因子TBX3的蛋白抑制再激活机制
日期:2024-05-24
2024年5月15日,来自南方科技大学生命科学学院的饶枫课题组联合天津医科大学赵丽团队与南方医科大学关海霞团队在 Nature Communications 上在线发表题为“Proteostatic reactivation of the developmental transcription factor TBX3 drives BRAF/MAPK-mediated tumorigenesis”的研究论文(1),该研究证明发育因子TBX3的蛋白稳态在肿瘤里再激活,从而介导了BRAF/MAPK驱动的去分化和肿瘤发生。
饶枫课题组长期研究细胞内蛋白质稳态的代谢调控与肿瘤发生发展,在过去数年间相继发现代谢分子六磷酸肌醇IP6可通过调控CRL泛素连接酶的拟素化失活来介导蛋白质组的泛素化稳态(2,3),在此基础上揭示了一个特异感知葡萄糖且受IP6门控的泛素连接酶: CRL4COP1 (4),并发现葡萄糖可以通过增强CRL4COP1的拟素化活化,在乳腺中过度降解p53从而加快乳腺肿瘤的生长(5)。发育因子TBX3的蛋白再激活驱动肿瘤发生是饶枫团队在蛋白质稳态调控与肿瘤研究领域再次取得的重要成果。
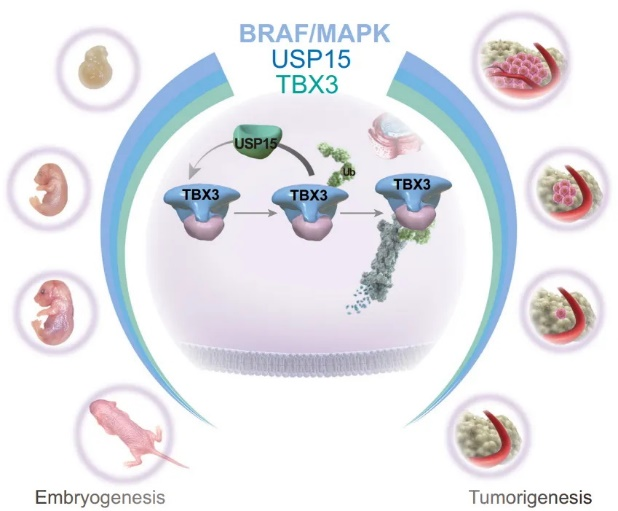
图1. 在去分化细胞状态、胚胎早期和肿瘤发生晚期,高BRAF/MAPK/USP15水平确保高丰度的TBX3。在分化细胞状态、出生后组织和初始转化过程中,BRAF/MAPK/USP15的低水平消耗TBX3。
在这个研究中,作者首先鉴定了USP15作为TBX3的DUB,使TBX3去泛素化并拮抗UPS依赖性降解。BRAF/MAPK通路通过Usp15介导的去泛素化稳定TBX3在胚胎发育和肿瘤发生过程中起作用,因此基因敲除Usp15可导致与TBX3突变类似的器官发育中断和肿瘤发生抑制。Tbx3和Usp15缺乏还会导致分化增强。BRAFV600E突变在超过一半的甲状腺肿瘤中发生,该突变驱动的甲状腺肿瘤发生发展过程伴随着USP15-TBX3轴的重新活化,是治疗的潜在新靶点。该研究结果揭示了通过胚胎发生和肿瘤发生调控TBX3蛋白稳态的调控网络,从而不仅揭示了TBX3解答的细胞事件,还支持了BRAF/MAPK导向的祖细胞与癌细胞命运之间的机制联系。
饶枫、赵丽和关海霞教授是论文的共同通讯作者。饶枫课题组的研究助理教授苏杨参与了论文的发表。南科大是该论文的共同通讯单位。研究工作得到了国家自然科学基金优青和面上项目的资助与支持。
文章链接:https://www.nature.com/articles/s41467-024-48173-9
饶枫课题组连接:https://faculty.sustech.edu.cn/raof/
1. Zhenlei Zhang #, Yufan Wu#, Jinrong Fu#, Xiujie Yu, Yang Su, Shikai Jia, Huili Cheng, Yan Shen, Xianghui He, Kai Ren, Xiangqian Zheng, Haixia Guan*, Feng Rao *, Li Zhao*. Proteostatic reactivation of the developmental transcription factor TBX3 drives BRAF/MAPK-mediated tumorigenesis. Nat Commun 2024 May 15;15(1):4108.
2. Scherer PC#, Ding Y#, Liu Z, Xu J, Mao H, Barrow JC, Wei N, Zheng N, Snyder SH*, Rao F*. Inositol hexakisphosphate (IP6) generated by IP5K mediates cullin-COP9 signalosome interactions and CRL function. Proc Natl Acad Sci U S A (2016) 113(13):3503-3508.
3. Lin H#, Zhang X#, Liu L#, Fu Q, Zang C, Ding Y, Su Y, Xu Z, He S, Yang X, Wei X, Mao H, Cui Y, Wei Y, Zhou C, Du L, Huang N, Zheng N, Wang T*, Rao F*. Basis for metabolite-dependent Cullin-RING ligase deneddylation by the COP9 signalosome. Proc Natl Acad Sci U S A (2020) 117(8):4117-4124.
4. Lin H#, Yan Y#, Luo Y#, So WY, Wei X, Zhang X, Yang X, Zhang J, Su Y, Yang X, Zhang B, Zhang K, Jiang N, Chow BK, Han W, Wang F, Rao F*. IP6-assisted CSN-COP1 competition regulates a CRL4-ETV5 proteolytic checkpoint to safeguard glucose-induced insulin secretion. Nat Commun (2021) 12(1):2461.
5.Su Y#, Luo Y#, Zhang P, Lin H, Pu W, Zhang H, Wang H, Hao Y, Xiao Y, Zhang X, Wei X, Nie S, Zhang K, Fu Q, Chen H, Huang N, Ren Y, Wu M, Chow BKC, Chen X, Jin W, Wang, F*, Zhao L*, Rao F*. Glucose-induced CRL4COP1-p53 axis amplifies glycometabolism to drive tumorigenesis. Molecular Cell 2023 Jul 6;83(13):2316-2331.
供稿:生命科学学院饶枫课题组
编辑:文卿
审核:万峻
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
