南科大赵燕团队合作揭示VMP1和TMEM41B是β-冠状病毒侵染过程中DMV形成的关键宿主因子
日期:2022-05-23
近日,南方科技大学生命科学学院助理教授赵燕课题组联合中国科学院生物物理研究所研究员邓红雨课题组在Journal of Cell Biology上发表了题为VMP1 and TMEM41B are essential for DMV formation during β-coronavirus infection的研究论文,揭示了内质网定位的自噬蛋白VMP1和TMEM41B是β-冠状病毒侵染过程中必需的宿主因子,并在DMV形成的不同步骤发挥重要作用。
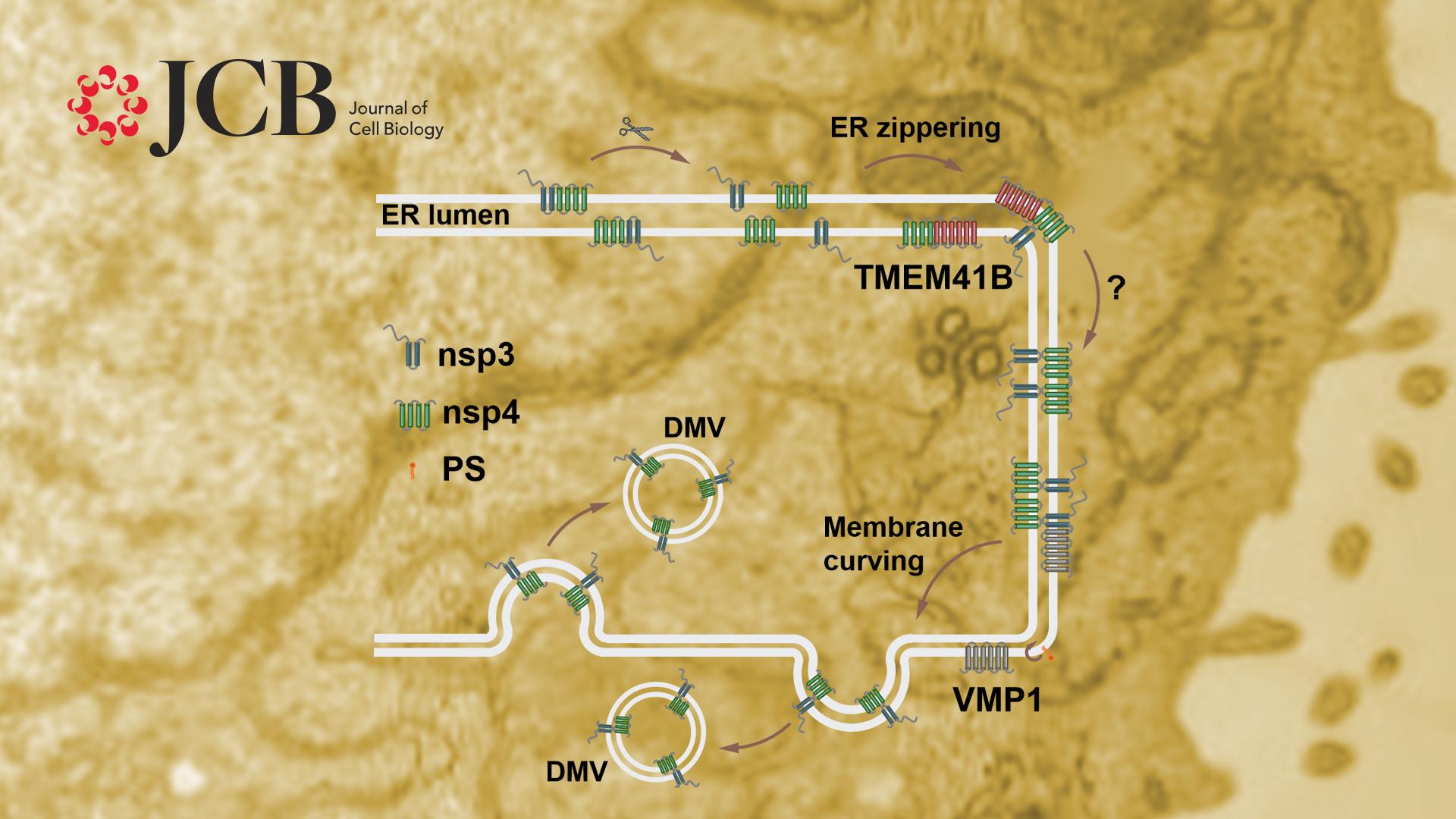
β-冠状病毒家族属于正义单链RNA病毒,包括SARS-CoV-2, SARS-CoV和MERS-CoV等。β-冠状病毒侵入宿主细胞后,其基因组RNA借助宿主的翻译系统翻译成两条多蛋白链ORF1a和ORF1ab,进而被切割成16个成熟的病毒蛋白,即非结构蛋白(non structure protein, nsp)nsp1-16。部分nsp蛋白可以引起宿主细胞内膜系统的重塑,形成病毒复制细胞器(replication organelle, RO),其中最主要的RO是双层膜囊泡(double membrane vesicle, DMV)。病毒复制转录复合体隐藏于RO中进行工作,保护新生成的RNA链免于被宿主细胞识别及清除。但是DMV形成的分子机制和调控机理,以及是否有宿主因子参与这一过程均不清楚。
内质网VMP1和TMEM41B是自噬和脂质代谢过程的关键蛋白。近期全基因组CRISPR/Cas9筛选发现VMP1和TMEM41B在SARS-CoV-2的侵染过程中也发挥了重要功能,但具体作用步骤不清。研究人员首先验证了VMP1或TMEM41B缺失后,β-冠状病毒家族小鼠肝炎病毒(mouse hepatitis virus, MHV,BSL-2水平)可以入侵细胞,但是无法正常复制。电镜观察发现在MHV感染的VMP1或TMEM41B 敲除的细胞中,检测不到DMV,提示VMP1和TMEM41B为DMV形成所必需。
过去研究发现哺乳动物细胞中外源表达的β-冠状病毒蛋白nsp3和nsp4可以通过相互作用引起内质网腔狭窄化,并进一步弯曲形成DMV样双层膜囊泡,这也为研究DMV形成机制提供了良好的模型。研究人员证实了表达SARS-CoV-2的nsp3和nsp4也可以诱导DMV形成,并且通过荧光蛋白蛋白酶保护实验(fluorescence protease protection, FPP)发现nsp3位于DMV的外膜上,而nsp4位于DMV内膜上,且这种分布对于DMV形成必不可少。
利用nsp3和nsp4诱导DMV形成这一模型,研究人员发现TMEM41B敲除细胞中, nsp3和nsp4的结合显著减少,而通过表达TMEM41B可以促进nsp3和nsp4的结合。VMP1缺失不影响nsp3和nsp4的相互作用和内质网的狭窄化,但是狭窄的内质网形成同心圆样结构,而非正常的DMV。以上结果说明VMP1和TMEM41B在DMV形成的不同阶段发挥功能。
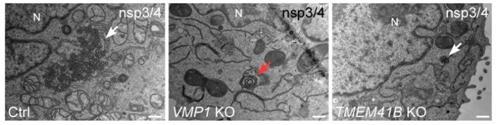
图1. 对照细胞(Ctrl)中,外源表达nsp3和nsp4诱导形成大量DMV样结构(白色箭头)。VMP1敲除细胞中狭窄的内质网形成同心圆样结构(红色箭头),TMEM41B敲除细胞中DMV形成效率下降
研究人员在线虫中进行全基因组RNAi筛选发现,敲低磷脂酰丝氨酸(phosphatidylserine, PS)的合成酶基因pssy-1可以抑制epg-3(VMP1的线虫同源基因)突变线虫表皮细胞中变大的脂滴。研究人员的结果表明在哺乳动物细胞中敲降pssy-1的同源基因PTDSS1也可以抑制VMP1敲除引起的大脂滴,并可以部分逆转其DMV异常的表型。过去研究发现VMP1具有磷脂翻转酶(scramblase)功能,结合本研究结果提示PS可能在DMV的形成中发挥了关键作用。
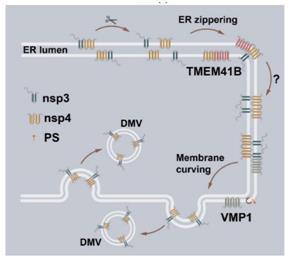
图2. VMP1和TMEM41B在DMV形成不同阶段发挥功能的示意图
综上所述,本研究表明SARS-CoV-2的非结构蛋白nsp3和nsp4分别位于DMV膜的两侧,这一独特的分布对于狭窄的内质网弯曲形成DMV囊泡非常重要。内质网自噬蛋白VMP1和TMEM41B在DMV生成的不同步骤发挥着关键作用,而PS累积可能是VMP1敲除细胞中多种膜结构缺陷的重要原因。这些发现为病毒复制过程中宿主因子如何协同病毒蛋白调控内膜系统的重塑提供了分子机制。
南方科技大学生命科学学院博士研究生李萌、中科院生物物理所博士后季明明和中科院生物物理所博士研究生孙龙为共同第一作者。赵燕和邓红雨为论文通讯作者。南方科技大学生物医学工程系副教授李依明、博士后周露露为该项研究的合作作者。清华大学生命科学学院蛋白质研究技术中心李英为本研究提供了技术支持。本研究得到了科技部国家重点研发计划、国家自然科学基金、中国科学院以及深港脑科学创新研究院等项目支持。
供稿:生命科学学院
文字:赵燕
通讯员:付文卿
主图:丘妍
编辑:朱增光
最新动态
-
校地协同 双向赋能——生命科学学院党委与赣州章贡区委组织部签署合作备忘录
Date:2025-11-03
-
生命科学学院举办“羽动青春,党建同行”羽毛球活动
Date:2025-10-27
-
追寻红色足迹 汲取奋进力量——基础免疫与微生物学系教职工党支部赴穗莞两地开展红色教育实践活动
Date:2025-10-27
-
院企携手共筑儿童脑健康防线,南科大生科院-艾美研究中心正式启动
Date:2025-10-23
