南科大邓兴旺团队合作研究揭示紫外光B受体UVR8结合COP1的分子机制
日期:2022-05-12
近日,南方科技大学生命科学学院长期杰出访问教授邓兴旺联合华中农业大学殷平教授团队,揭示了植物紫外光B(UV-B)受体UVR8结合光形态建成核心抑制因子COP1-SPAs复合物并与该复合物的底物蛋白HY5竞争性结合COP1-SPAs的分子机制。相关论文以“Structural insight into UV-B–activated UVR8 bound to COP1”为题发表在Science Advances。
光是植物生长发育必不可少的环境因子。植物通过不同的光受体来感知光,从而启动光形态建成。COP1-SPAs复合物是植物光形态建成中的核心抑制因子,该复合物在植物体内发挥E3泛素连接酶的功能,参与一系列光形态建成核心调控因子的降解。光激活的光受体(例如UV-B受体UVR8,蓝光受体CRYs)能够负调控COP1-SPAs复合物的E3泛素连接酶活性,抑制COP1-SPAs复合物底物的降解,从而使植物体启动光形态建成。不同光受体介导的信号通路如何调节COP1-SPAs活性的分子机制未知,其中最大研究困难在于COP1-SPAs复合物蛋白难于被表达纯化及表征活性。
在该研究中,研究人员经过长时间的探索,最终成功在异源体系中表达纯化出均一稳定的COP1-SPA4复合体蛋白,这为后续工作开展奠定了基础。研究人员在体外重构了UVR8-COP1-SPA4介导的UV-B 信号通路。结果表明UV-B可以使处于二聚体基态的UVR8激活为单体。光激活的单体UVR8可以在体外与COP1-SPA4复合物的底物HY5竞争结合该复合物,形成新的稳定复合物UVR8-COP1-SPA4。而UV-B信号通路的负调控因子RUP2则可以将UVR8从UVR8-COP1-SPA4复合体上解离下来,促进UVR8的重新二聚化从而失去活性。
随后,研究人员解析了光激活态UVR8-COP1复合体的冷冻电镜结构,分辨率为3.1Å。该结构表明光激活的UVR8与COP1的WD40结构域形成两个互作界面,生化实验证明这两个互作界面是UVR8和COP1发生互作以及竞争COP-SPA底物HY5所必需的。该结构也首次揭示了光激活态的UVR8核心结构域的结构特征,并与之前报道的其他野生型或者突变型UVR8核心结构域比对,鉴定到UVR8的激活态突变体UVR8W285A,D96N,D107N和UVR8W285A,G01S。此外,研究人员推测RUP2可能也以类似于UVR8-COP1互作的方式与UVR8发生相互作用,从而使激活态的UVR8从COP1-SPA4-UVR8复合体上解离。
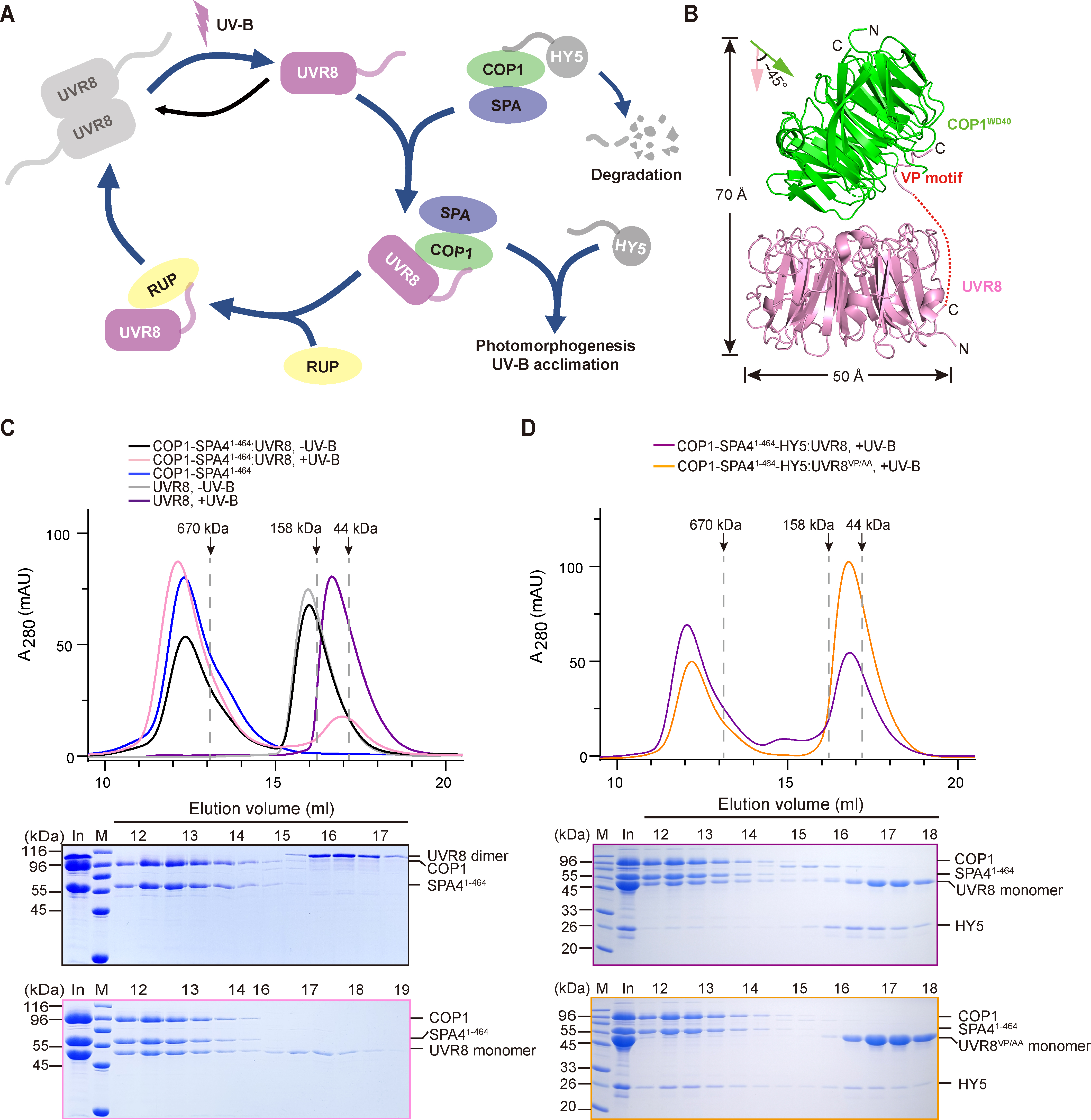
图1:光激活UVR8-COP1-SPA4复合体介导的UV-B信号转导通路
该研究阐明了光激活UVR8和COP1发生相互作用以及与COP1-SPA底物HY5竞争性结合COP1-SPA的分子机制。研究结果不仅为理解植物光信号转导调控奠定了基础,并为光遗传学工具蛋白的开发提供理论基础,也为培育优良农林作物品种提供科学指导。
邓兴旺和殷平为共同通讯作者,邓兴旺团队研究助理教授李健也参与了该研究。前期冷冻样品制备和样品筛选主要在华中农业大学电镜平台完成,冷冻电镜数据收集在南方科技大学冷冻电镜中心完成。该研究得到了科技部基金、国家自然科学基金、洪山实验室基金、武汉市应用基础前沿项目基金以及南方科技大学校长基金的资助。
论文链接:https://www.science.org/doi/10.1126/sciadv.abn3337
供稿:生命科学学院
文字:王意东、李健
通讯员:付文卿
主图:丘妍
编辑:朱增光
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
