南科大龚欣课题组揭示视觉系统关键脂质转运蛋白ABCA4的底物识别和转运机制
日期:2021-07-06

近日,南方科技大学生命科学学院生物系副教授龚欣课题组在Nature Communications在线发表了题为“Structural basis of substrate recognition and translocation by human ABCA4”的研究论文。该研究报道了视觉系统关键脂质转运蛋白ABCA4三种不同状态的原子分辨率冷冻电镜结构,展示了ABCA4与底物的特异性识别机制,以及ATP驱动脂质底物转运过程中的构象变化,揭示了ABCA4对脂质底物独特的“侧向进入和挤压”的转运机制。
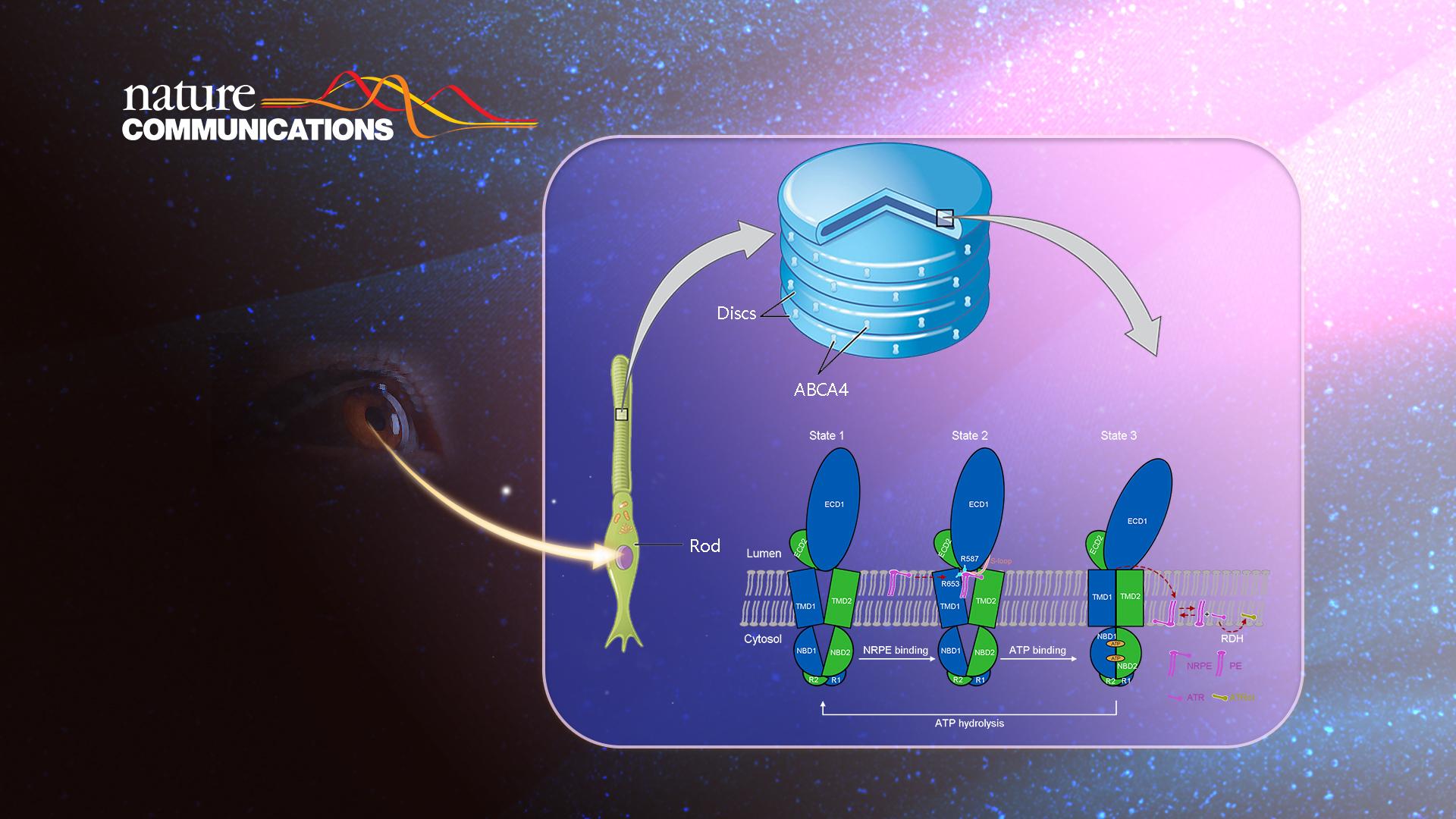
ABCA4是视网膜感光细胞或视网膜色素上皮细胞中的脂质内向翻转酶,可以将磷脂酰乙醇胺(PE)和全反式视黄醛(ATR)形成的脂质衍生物—视黄基磷脂酰乙醇胺 (NRPE),从外节膜盘的腔内侧转运到细胞质侧。随后,NRPE会水解为ATR和PE,其中的ATR会被细胞质内的视黄醛还原酶催化形成全反式视黄醇(ATRol),从而重新回到视循环。如果ABCA4的脂质转运功能受损,会使得ATR和NRPE在外节膜盘的腔内侧发生过量积累,过量积累的ATR和NRPE会进一步不可逆的形成具有毒性的双视黄基衍生物,最终引起一系列的视网膜退行性疾病,包括最为常见的遗传性黄斑变性疾病、年龄相关的黄斑变性、色素性视网膜炎和锥杆营养不良等。尽管ABCA4在视觉系统脂质转运、视循环过程中起着至关重要的作用,但此前对于ABCA4的分子结构、底物识别和转运机制还缺乏相应的研究。
该研究首先通过体外重组表达、纯化的方法获得了人源ABCA4的蛋白,并在体外测得了ABCA4的ATPase活性和相应的酶动力学参数。随后,利用单颗粒冷冻电镜技术,成功解析了人源ABCA4处于三种不同状态3.3–3.4 Å分辨率的三维结构,分别是apo、结合底物NRPE、以及结合ATP的结构(图1)。
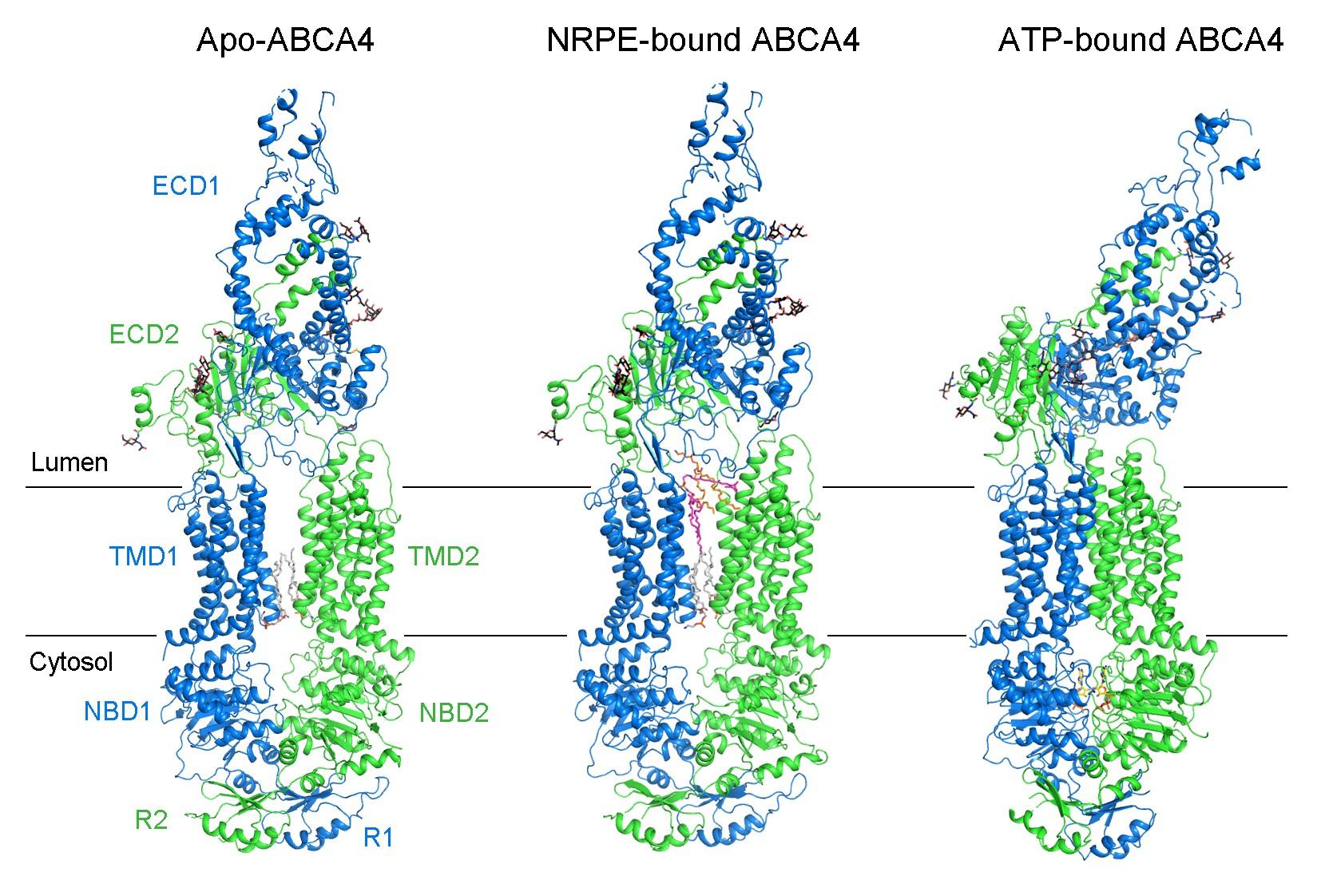
图1. 人源ABCA4处于apo、结合NRPE以及结合ATP状态的结构
在与NRPE底物的复合物结构中,NRPE被夹在ABCA4两个跨膜结构域(TMD1和TMD2)之间,完全暴露于脂质双分子层,表明脂质底物NRPE可以从脂质双分子层的侧向进入跨膜区的底物结合位点(图2a, b)。NRPE的磷酸基团主要由TMD1和胞外区结构域ECD1中两个带正电荷的Arg的侧链识别,酰基链与TMD1形成了广泛的疏水相互作用,ATR基团主要与ECD1中S-loop上的四个芳香族残基形成疏水相互作用(图2c)。该研究进一步通过ATR可以激活ABCA4体外ATPase水解活性的特点,证明了从结构上观察到的NRPE结合位点的准确性(图2d)。
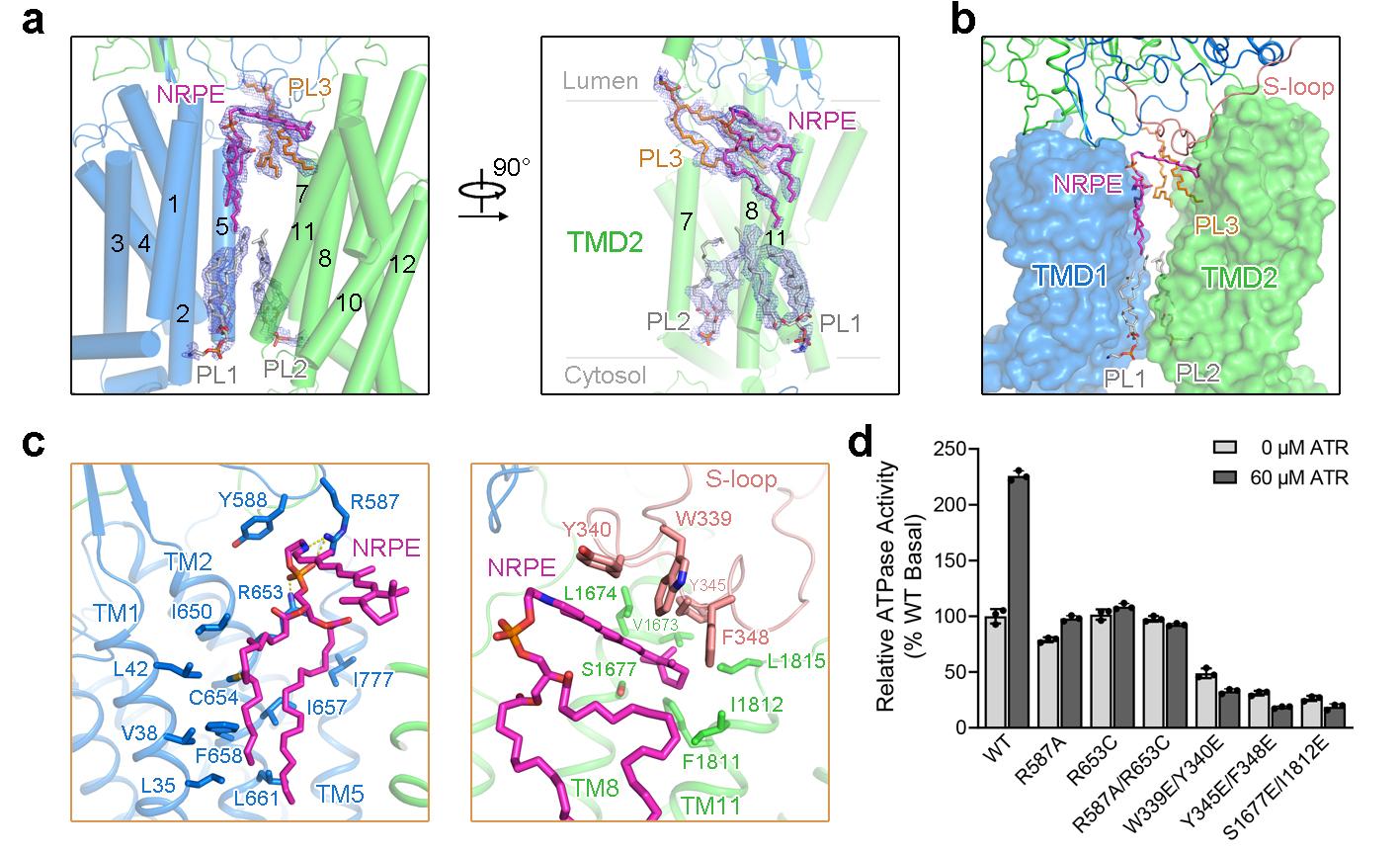
图2. NRPE底物结合位点
在与ATP的复合物结构中,跨膜区TMD呈现出关闭的构象,在该构象下,NRPE被挤出底物结合位点(图1)。基于解析的三个高分辨结构,该研究最后提出了ABCA4对底物NRPE的转运模型(图3)。在apo状态下,TMD呈现V形横向开口构象,允许NRPE从脂质双分子层的侧向进入(state 1)。NRPE与TMD1和ECD1中的两个带正电荷的Arg残基相互作用,并进一步与TMD1和ECD1上的S-loop形成广泛的疏水相互作用(state2)。在与ATP结合后,伴随着ATP诱导的核酸结合结构域NBD的闭合,TMD发生构象变化并关闭,将NRPE挤出底物结合位点并翻转至脂质双分子层另一侧(state3)。该研究为ABCA4的功能研究以及针对相关疾病的药物研发提供了重要的结构基础,也为阐明ABCA转运蛋白底物识别和转运机制提供了新见解。
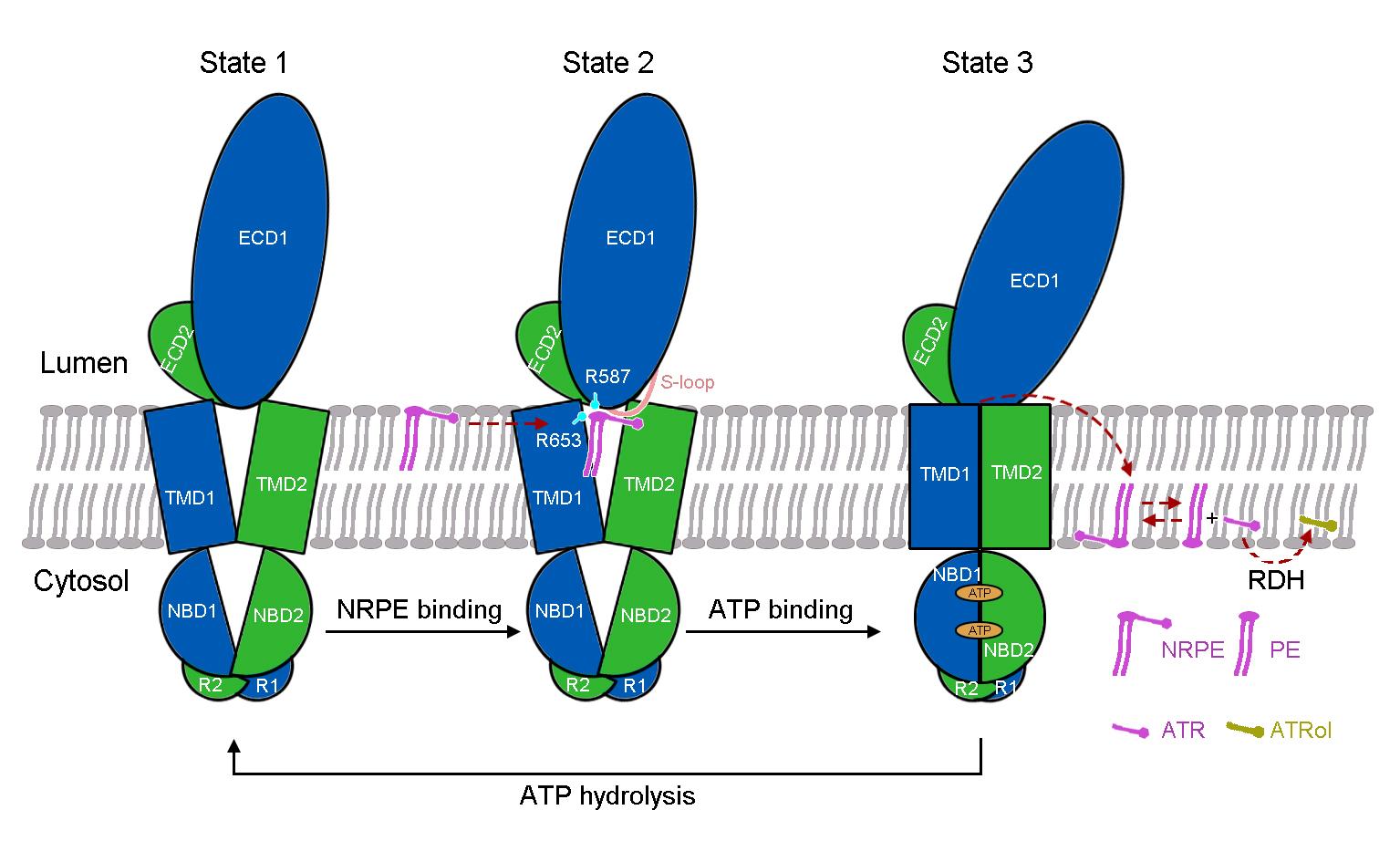
图3. ABCA4介导的NRPE识别和转运的工作模型
龚欣为该论文的通讯作者,课题组研究副教授谢田、生物系2019级硕士研究生张子珂为本论文的共同第一作者。南科大是论文唯一单位。该研究得到了国家自然科学基金、广东省杰出青年基金、深圳市优秀青年基金等项目的资助。该研究中电镜数据的收集和处理,均在南科大冷冻电镜中心完成,得到了中心的大力支持。
论文链接:https://doi.org/10.1038/s41467-021-24194-6
供稿:生命科学学院
文字、图片:龚欣课题组
通讯员:付文卿
主图:丘妍
编辑:朱增光
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
