生物系魏志毅课题组和余聪课题组共同揭示细胞“物流系统”分子机制
日期:2020-12-01
近日,南方科技大学生物系副教授魏志毅课题组与余聪课题组合作在在Science Advances上以“F-actin disassembly factor MICAL1 binding to Myosin Va mediates cargo unloading during cytokinesis”为题发表研究论文,揭示细胞内广泛存在的分子马达蛋白所介导的物质运输的新机制。

类似现实世界中复杂的物流系统,细胞内物质的运输及分配也需要进行严格的时空调控,保证货物可以在准确的时间被输送到指定的地点,发挥特定的生物学功能,这是维持细胞正常生长、增殖、分裂、分化等生命活动的重要基础。细胞内物质的有序运输,依赖于细胞骨架和分子马达蛋白二者相互配合来完成。前者相互交叉形成网络,分布于整个细胞中,为细胞内各类物质转运提供轨道;而后者则是胞内物质运输的直接承载者,负载货物行走于细胞骨架构成的轨道上,将货物运送到特定区域。一旦细胞内物质运输体系发生紊乱,则会引发各类疾病。研究表明,多种神经退行性疾病,如阿尔兹海默症、亨廷顿舞蹈症等,都与神经元轴突中分子马达蛋白介导的物质运输受阻有关。同时,糖尿病,肿瘤和心血管类疾病的发生也都与胞内囊泡运输失调息息相关。因此,对分子马达蛋白介导的胞内物质运输的机理研究一直是生命科学领域的热点。
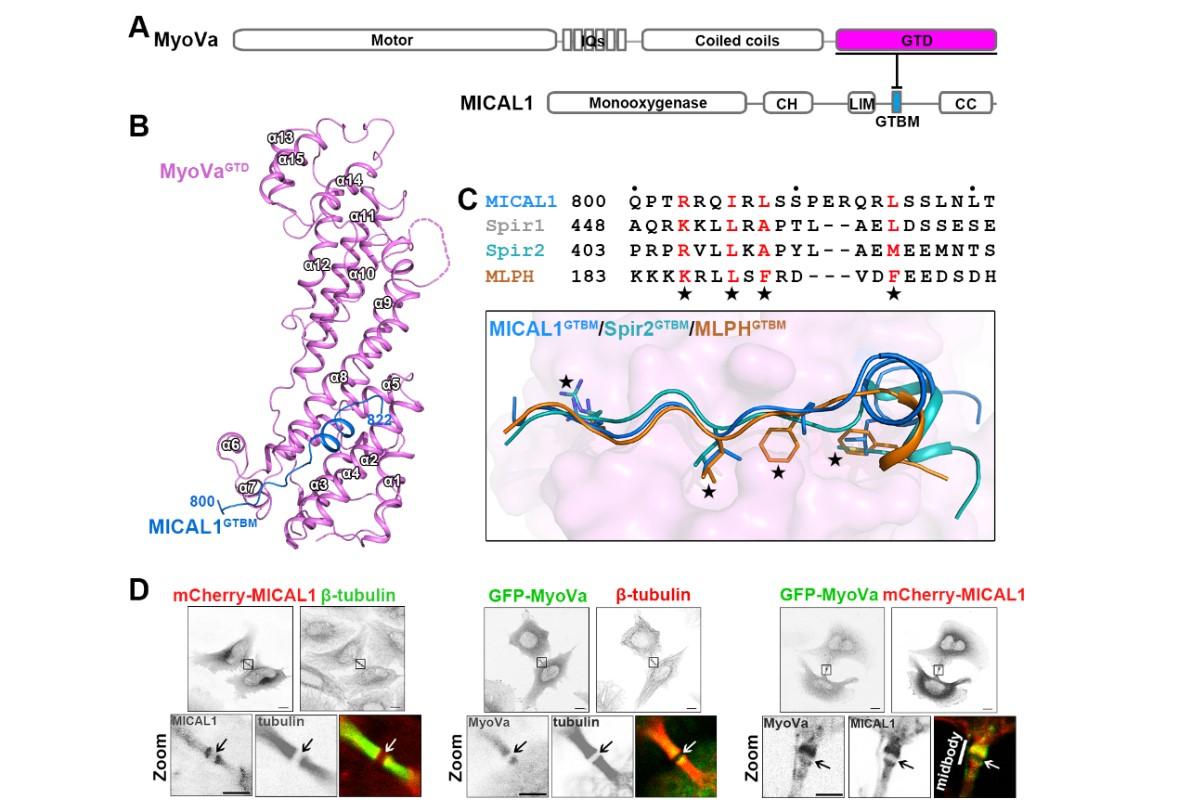
图1. MyoVa和MICAL1相互结合并共定位于细胞分裂中间体(midbody)
V型肌球蛋白是发现最早也是最具代表性的在微丝细胞骨架上行走的运输型肌球蛋白,对其结构和功能的研究一直引领着对于整个肌球蛋白家族功能的理解。魏志毅、余聪的研究以人体中一类常见的V型肌球蛋白(MyoVa)作为研究对象,发现一种细胞骨架解聚因子MICAL1可以直接结合MyoVa,并与MyoVa共定位于细胞分裂中间体(一种决定细胞分裂的重要细胞器)。进一步的细胞实验显示,MICAL1招募MyoVa并调控其运输的货物囊泡成功卸载于中间体区域,为细胞分裂提供所需的信号分子和膜组分。通过结构生物学分析,该研究团队发现微丝细胞骨架解聚因子和聚合因子可以竞争性地与MyoVa相结合,并通过控制MyoVa行走轨道的组装和去组装,对MyoVa的货物运输进行调控,这一发现得到了生物化学和细胞生物学多种方法的验证。根据这些研究发现,文章提出了V型肌球蛋白的货物运输新机制。在货物转运的起点,V型肌球蛋白招募细胞骨架聚合因子来“铺路”并启动运输;到达目的地后,微丝解聚因子通过竞争结合V型肌球蛋白, 促使细胞骨架聚合因子离开,同时进行“拆路”,终止V型肌球蛋白的运输从而卸载货物。该研究首次提出分子马达蛋白可以在不同的时间和地点,通过竞争性招募不同的行走轨道调节因子,进而控制其行走轨道的动态变化来调控货物的准确装载、运输和卸载,对胞内物质运输的时空调控提供了一种全新的思路。
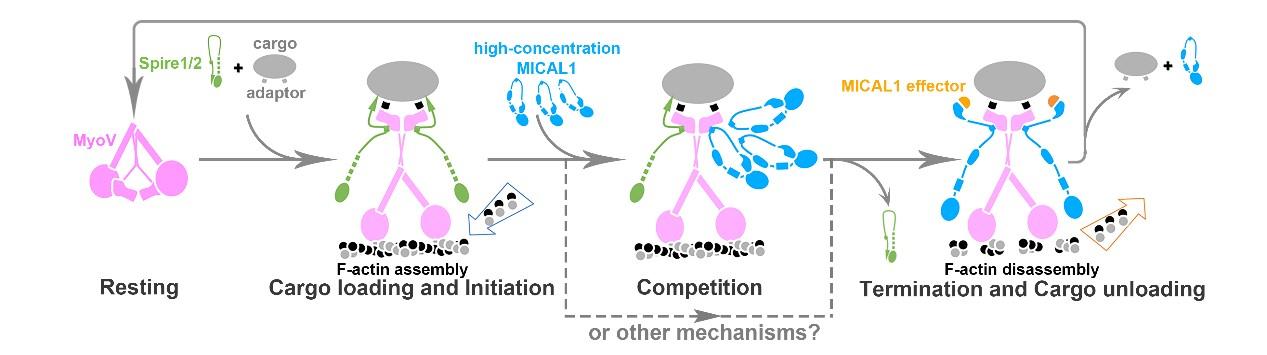
图2. V型肌球蛋白竞争性招募微丝细胞骨架聚合因子Spire和解聚因子MICAL1来控制微丝动态变化以运输并卸载货物的分子模型
魏志毅课题组研究助理教授牛锋锋、余聪课题组科研助理孙康为论文的共同第一作者,魏志毅和余聪为共同通讯作者,分析测试中心博士魏闻捷参与了细胞数据的整理和分析,南方科技大学为论文的第一通讯单位。研究得到了国家自然科学基金、广东省自然科学基金、广东省科技计划项目、深圳市科创委基金、深港脑科学创新研究院、南方科技大学分析测试中心和上海光源的大力支持。
文章链接:https://advances.sciencemag.org/content/6/45/eabb1307
供稿:生物系魏志毅课题组
通讯员:魏志毅、付文卿
编辑:程雯璟
主图设计:丘妍
最新动态
-
蕙质兰心·芳华绽放|生科院举办“三八”国际妇女节主题插花活动
Date:2026-03-06
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
