南科大生科院刘忠民团队揭示了sulindac抑制人源MRP4蛋白 (hMRP4) 转运底物PGE1的工作机制
日期:2023-05-23
近日,南方科技大学生命科学学院助理教授刘忠民课题组联合浙江大学王勇教授团队在学术期刊Communications Biology上在线发表了题为“Structural basis for substrate and inhibitor recognition of human multidrug transporter MRP4”的研究论文。该研究揭示了sulindac抑制人源MRP4蛋白 (hMRP4) 转运底物PGE1的工作机制(图1)。
hMRP4广泛分布在人体内各种组织和细胞类型中,并对多种抗病毒、抗癌、以及抗生素等药物产生外排作用,导致多药耐药性的产生,从而影响治疗效果。另外,hMRP4还转运各种内源性信号分子,包括cGMP、叶酸、二十烷酸、尿酸、PGE1、白三烯和类固醇。因此,hMRP4在人体的各种生理和病理过程中起着重要作用;然而,hMRP4转运底物的工作机制尚未明确。
相关的研究证实hMRP4的突变与类风湿关节炎、白血病、小细胞肺癌、炎症性气道疾病、血脑屏障功能障碍、分泌性腹泻、以及心血管等多种疾病密切相关。PGE1作为hMRP4的转运底物,参与了细胞内众多信号通路。研究发现抑制hMRP4的活性可以增加PGE1诱导环核苷酸依赖性血小板抑制作用。sulindac是一种非甾体抗炎药(NSAID),可以阻断环氧合酶-1和-2的活性来抑制前列腺素信号通路;同时,sulindac也可以作为抑制剂,抑制hMRP4的转运活性。因此,研究sulindac抑制hMRP4转运PGE1的工作机制具有重要的生物医学意义。
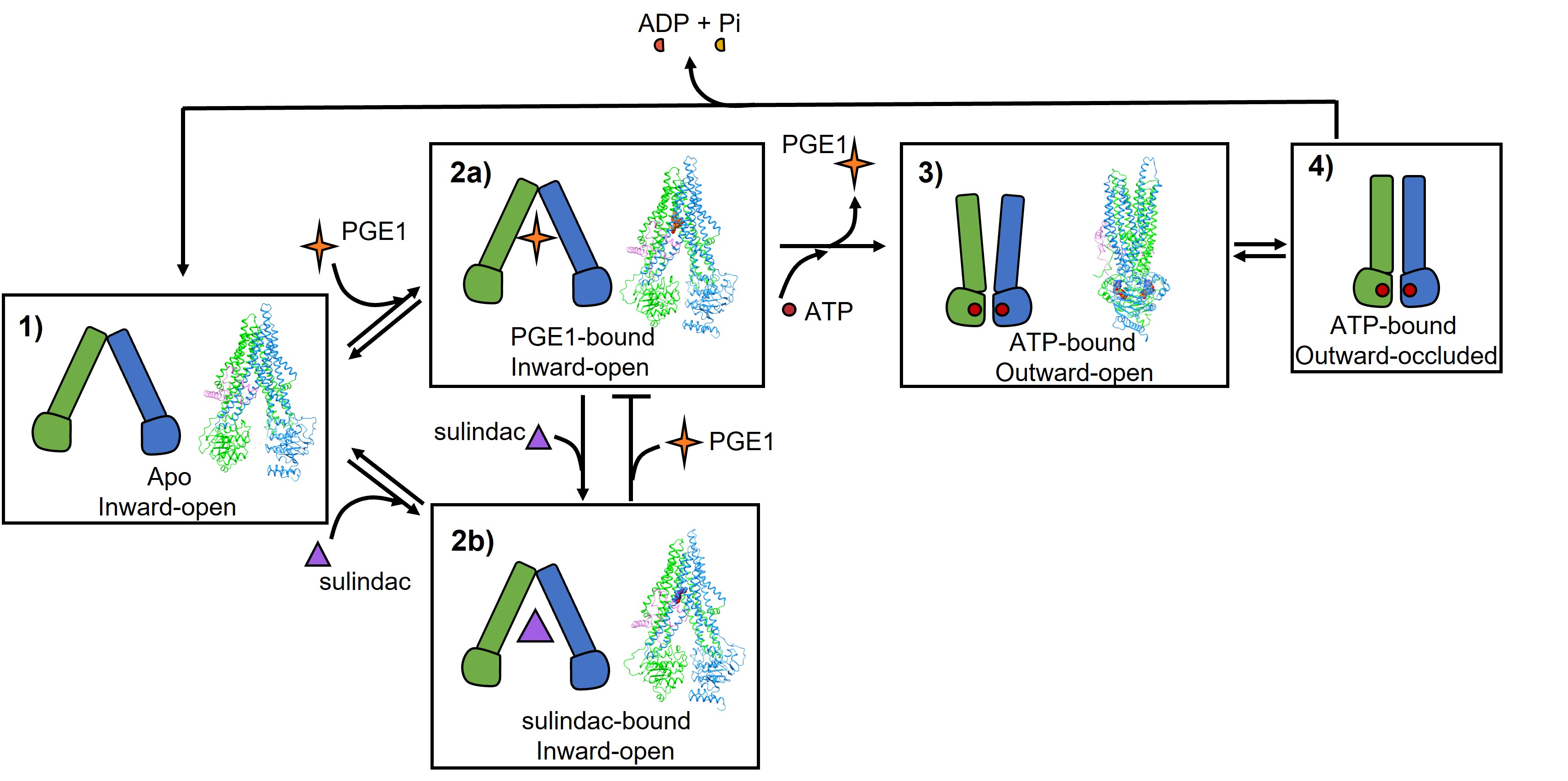
图1 hMRP4底物转运及小分子抑制机制
本研究中,研究人员使用单颗粒冷冻电子显微镜技术(cryo-EM)首次解析了apo inward-open, PGE1-bound inward-open, sulindac-bound inward-open, 以及ATP-bound outward-open等四种不同构象的hMRP4结构。结合分子动力学模拟的分析结果,我们明确了hMRP4转运底物的工作机制;另外,研究人员证实了抑制剂sulindac与底物PGE1竞争性结合相同的疏水结合口袋,阐明了sulindac抑制hMRP4转运底物的工作机理。相关研究成果对后续研发靶向hMRP4蛋白的药物提供重要线索。
南方科技大学生命科学学院博士生黄颖、薛晨阳为本论文共同第一作者,刘忠民和浙江大学生命科学学院的王勇为本文共同通讯作者。南科大为论文第一单位。冷冻电镜数据收集和处理得到了南科大冷冻电镜中心和水木未来科技有限公司的支持。该工作得到了国家自然科学基金、深圳市科创委的资助。
论文链接:
https://www.nature.com/articles/s42003-023-04935-7
供稿:刘忠民课题组
编辑:付文卿
审核:黄嘉欣
最新动态
-
南科大 Andrew P. Hutchins 团队揭示 BRD8 调控干细胞多能性状态的核心机制
Date:2024-12-25
-
生命科学学院召开2024年度年会
Date:2024-12-17
-
南科大宋毅团队揭示植物塑造抗旱微生物组的遗传和生态学机制
Date:2024-12-10
-
南科大陈小菁课题组揭示海马空间认知功能的发育机制
Date:2024-12-04
