南科大生科院饶枫课题组合作发现神经调控代谢过程中的GPCR新信使IP7
日期:2021-11-01
近日,南方科技大学生命科学学院副教授饶枫课题组和中国科学技术大学生命科学学院教授王朝课题组合作,在Nature Metabolism杂志在线发表了题为:“5-IP7 is a GPCR messenger mediating neural control of synaptotagmin-dependent insulin exocytosis and glucose homeostasis”的研究论文,报道了一个新的GPCR信使: IP7,以及其感应副交感神经信号刺激胰岛素分泌的功能和分子机制。

糖尿病的发生一般伴有胰岛素水平的异常。因此,胰岛素分泌的严格调控对于机体维持葡萄糖稳态具有重要的生理病理意义。体内β细胞胰岛素分泌受到葡萄糖、激素、神经递质等的严格调控。副交感神经刺激胰岛素分泌是其中一种重要机制。副交感信号在β细胞里感知的信号通路以及如何刺激胰岛素囊泡释放,并不完全清楚。
高级多磷酸肌醇是源于GPCR信使IP3,由一系列肌醇激酶层级磷酸化所形成的代谢小分子,进化上保守但功能所知甚少 (图1)。饶枫课题组主要研究以高级多磷酸肌醇为代表的细胞内新兴小分子信使的功能机制。曾发现六磷酸肌醇(IP6)是促进CSN-CRL泛素连接酶调控复合物组装的分子间“胶水”;还通过表征IP6结合缺失的CSN2-K70E突变体小鼠,发现了一条感知葡萄糖刺激胰岛素分泌的蛋白质降解通路。
焦磷酸肌醇5-IP7(IP7)由其合成激酶IP6K磷酸化IP6生成。IP7能量高,在 IP6K和磷酸酶(DIPP)的作用下与IP6动态转换,具有信使分子的瞬时合成降解属性。根据IP6K敲除小鼠和细胞系的表型,IP7应参与很多生理与疾病过程,如调控肿瘤细胞凋亡和转移的命运抉择。但是,IP7 的普适性作用原理和所转导的生理信号通路尚不清楚。
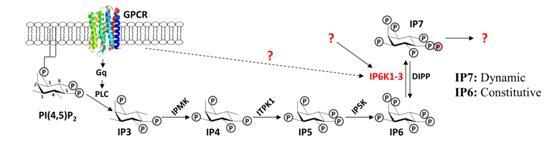
图1: 高级多酸肌醇代谢分子的信使功能与机制研究
IP6K介导的IP6-IP7间的动态转换可能参与了细胞对外界信号/刺激/胁迫的应答。然而,IP6K参与应答的信号以及IP7的靶标与作用机制未知。
在此项研究中,课题组首先解析了生理状态下IP6K1的磷酸化活化调控机制,在副交感神经激活时,分布于胰岛β细胞表面的乙酰胆碱受体接受到来自于神经末梢的乙酰胆碱,通过一系列信号转导过程(Ach-M3R-Gαq/11-PLC-PKC/PKD-IP6K1)磷酸化IP6K1,促进生成IP7(图2A)。随后,课题组通过构建模拟磷酸化修饰的IP6K1 S118/121D突变体小鼠和beta细胞IP6K1特异敲除的IP6K1fl/fl:MIP-Cre小鼠,并表征其相关代谢指标,发现副交感神经调控胰岛β细胞中的5-IP7生成可以促进胰岛素分泌和葡萄糖稳态调控。如发现IP6K1S118/121D鼠具有更高的血清胰岛素水平,更好的葡萄糖耐受,并且其islets也具有更强的胰岛素分泌能力。相反,IP6K1fl/fl:MIP-Cre小鼠表现出受损的葡萄糖诱导的胰岛素分泌以及更差的葡萄糖耐受。由此,课题组得出结论,IP6K1受副交感递质乙酰胆碱受体激活后,通过其酶活产物5-IP7实现促进胰岛素分泌的功能。这是关于IP6K酶活的生理调控的首次报道,是中枢调控外周的一项新发现。
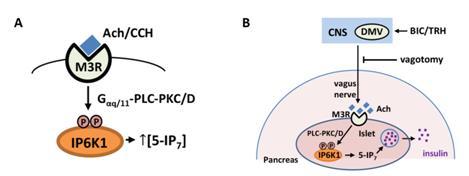
图2: 乙酰胆碱受体-Gq-PLC-PKC信号通路对IP6K1的磷酸化修饰调控路径和参与神经调控代谢的生理背景
为进一步解析IP7促进胰岛素分泌早的机制。课题组系统表征了胰岛的数量、大小和胰岛素含量与囊泡对接程度,发现IP7不参与这些过程。通过解析胰岛素分泌相关突触结合蛋白Syt7与磷酸肌醇复合物的晶体结构,课题组发现IP7可与PIP2竞争结合Syt7,从而抑制无刺激时的自发囊泡释放。在钙内流刺激的胰岛素囊泡与细胞膜融合过程中,钙离子可与5-IP7结合,从而促进Syt7与细胞膜上的PIP2结合,催发SNARE介导的囊泡与细胞膜自然融合。而IP7的前体IP6与钙离子的结合能力较弱,此差异在IP6K1激活时或IP6K1 S118/121D突变体里被放大,导致鼠胰岛素分泌高于正常水平(图3)。基于此,课题组提出,当Gq藕联的GPCR被激活时,IP7是与Ca2+共同作用的“共发”信使(coincident messenger)来参与囊泡释放。
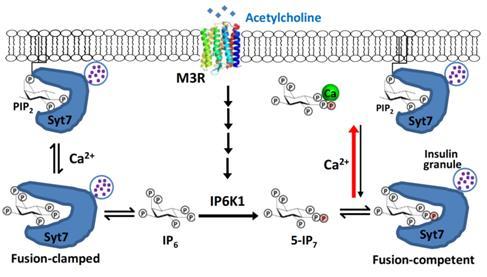
图3: 5-IP7与Ca2+作为乙酰胆碱受体GPCR通路下游的“共发”信使(coincident messenger)刺激胰岛素囊泡释放的作用模式图。
该研究首次发现IP7是Gq偶联的GPCR的第二信使,与著名的信使分子cAMP有类通性(注:cAMP是Gs偶联的GPCR的第二信使)。代谢小分子IP7更为广泛重要的信使功能有待进一步挖掘。
饶枫课题组博士生张晓哲、李娜,硕士生张隽,科研助理杨晓丽以及王朝课题组博士生张彦申为论文的共同第一作者。饶枫和王朝为论文的共同通讯作者。南科大是论文第一单位。此外,该研究得到了南科大生命科学学院院长、中国科学院院士张明杰,广州生物岛实验室教授韩卫平,北京生命科学研究所研究员齐湘兵,华大基因研究员任艳,华中科技大学教授马聪,南科大教授肖国芝、张文清,南科大第二附属医院教授姜楠以及西安交通大学教授王昌河团队的支持与帮助。该研究得到了深圳市科创委、国家自然科学基金、国家重点研发计划、广东省自然科学基金、中国科学技术大学“细胞动力学”教育部重点实验室、微尺度国家研究中心等的资助。
论文链接:https://www.nature.com/articles/s42255-021-00468-7
供稿:生命科学学院
文字:饶枫课题组
通讯员:付文卿
主图:丘妍
编辑:朱增光
最新动态
-
生命科学学院“发现绿美南科”校园动植物科普志愿讲解活动顺利开展
Date:2026-02-24
-
南科大曾福星团队联合Raven H. Huang团队阐明牙龈二氧化碳嗜纤维菌中PrfH识别停滞核糖体的双重机制
Date:2026-02-05
-
筑牢安全屏障,护航科研前行|生命科学学院开展寒假实验室安全检查及系列专项工作
Date:2026-02-03
-
生命科学学院举办“化学与结构生物学科研进展报告交流”总结暨表彰会议
Date:2026-01-09
